Câu 5.Đốt cháy hoàn toàn 1,92 g lưu huỳnh trong bình khí oxi. Tính thể tích khí SO2 (đktc) thu được sau phản ứng, biết hiệu suất phản ứng là 90%.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án D
S
+
O
2
→
S
O
2
0
,
05
0
,
05
m
o
l
n
S
=
1
,
6
/
32
=
0
,
05
m
o
l
V
S
O
2
=
0
,
05
.
22
,
4
=
1
,
12
l

S+O2-to>SO2
0,2--0,2----0,2 mol
n SO2=\(\dfrac{4,48}{22,4}\)=0,2 mol
=>m S=0,2.32=6,4g
=>VO2=0,2.22,4=4,48l

\(n_S=\dfrac{m_S}{M_S}=\dfrac{3,2}{32}=0,1mol\)
\(n_{O_2}=\dfrac{V_{O_2}}{22,4}=\dfrac{1,68}{22,4}=0,075mol\)
\(S+O_2\rightarrow\left(t^o\right)SO_2\)
0,1> 0,075 ( mol )
0,075 0,075 ( mol )
\(V_{SO_2}=V_{O_2}=1,68l\)

\(n_{O2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Pt : \(S+O_2\underrightarrow{t^o}SO_2|\)
1 1 1
0,15 0,15 0,15
a) \(n_S=\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
⇒ \(m_S=0,15.32=4,8\left(g\right)\)
b) \(n_{SO2}=\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
\(V_{SO2\left(dktc\right)}=0,15.22,4=3,36\left(l\right)\)
Chúc bạn học tốt

\(n_{SO_2}=\dfrac{V_{SO_2\left(ĐKTC\right)}}{22,4}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: \(S+O_2\underrightarrow{t^o}SO_2\)
...........1.........1........1......
...........0,3......0,3......0,3.....
a. \(m_S=n_S\cdot M_S=0,3\cdot32=9,6\left(g\right)\)
b. \(V_{O_2\left(ĐKTC\right)}=n_{O_2}\cdot22,4=0,3\cdot22,4=6,72\left(l\right)\)
\(V_{kk\left(ĐKTC\right)}=V_{O_2\left(ĐKTC\right)}\cdot5=6,72\cdot5=33,6\left(l\right)\)

\(n_S=\dfrac{3.2}{32}=0.1\left(mol\right)\)
\(n_{O_2}=\dfrac{1.12}{22.4}=0.05\left(mol\right)\)
\(S+O_2\underrightarrow{t^0}SO_2\)
\(0.05.0.05...0.05\)
\(\Rightarrow Sdư\)
\(V_{SO_2}=0.05\cdot22.4=1.12\left(l\right)\)
\(b.\)
\(S+O_2\underrightarrow{t^0}SO_2\)
\(0.1..0.1\)
\(V_{kk}=5V_{O_2}=5\cdot0.1\cdot22.4=11.2\left(l\right)\)

a, PT: \(S+O_2\underrightarrow{t^o}SO_2\)
Ta có: \(n_S=\dfrac{3,2}{32}=0,1\left(mol\right)\)
\(n_{O_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,1}{1}>\dfrac{0,05}{1}\), ta được S dư.
Theo PT: \(n_{SO_2}=n_{O_2}=0,05\left(mol\right)\) \(\Rightarrow V_{SO_2}=0,05.22,4=1,12\left(l\right)\)
b, Theo PT: \(n_{O_2}=n_S=0,1\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,1.22,4=2,24\left(l\right)\)
\(\Rightarrow V_{kk}=2,24.5=11,2\left(l\right)\)

Ta có: \(n_S=\dfrac{6,4}{32}=0,2\left(mol\right)\)
a. PTHH: S + O2 ---to---> SO2
Theo PT: \(n_{SO_2}=n_S=0,2\left(mol\right)\)
=> \(m_{SO_2}=0,2.64=12,8\left(g\right)\)
b. Theo PT: \(n_{O_2}=n_S=0,2\left(mol\right)\)
=> \(m_{O_2}=0,2.32=6,4\left(g\right)\)
a)S+O2-------->SO2
b)n S=6,4/32=0,2(mol)
Theo pthh
n SO2 =n S=0,2(mol)
V SO2=0,2.22,4=4,48(mol)
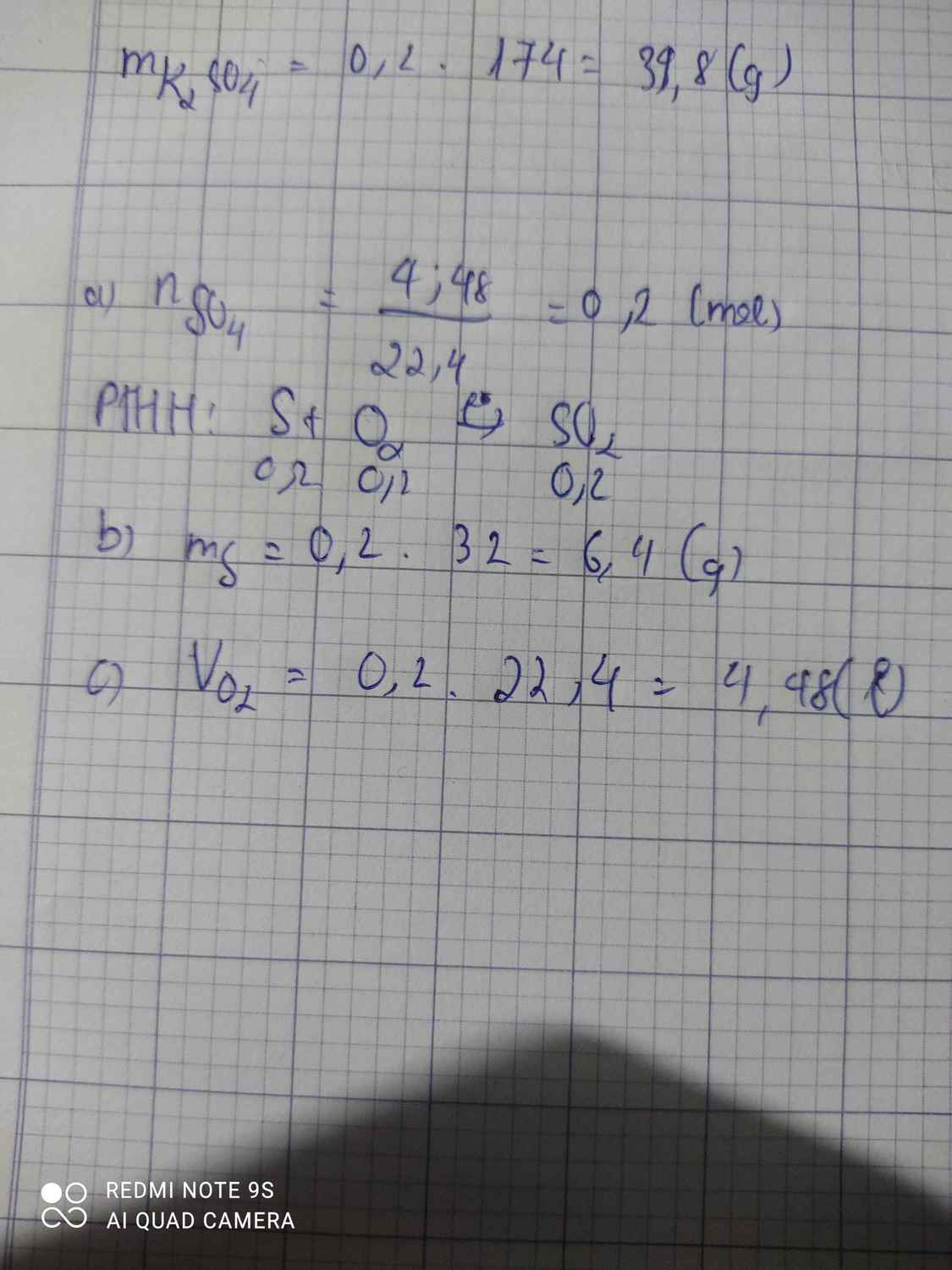
nS = 1,92/32 = 0,06 (mol)
PTHH: S + O2 -> (t°) SO2
Mol: 0,06 ---> 0,06 ---> 0,06
VSO2 (LT) = 0,06 . 22,4 = 1,344 (l)
VSO2 (TT) = 1,344 . 90% = 1,2096 (l)
nS= 0.06 mol
S + O2 -to-> SO2
Từ PTHH:
nSO2= 0.06 mol
VSO2= 1.344l
VSO2 thực = 1.344*90/100=1.2096l