Cho 0,896lit hh gồm C2H4 và C2H2 phản ứng hoàn toàn với dd Br2, thấy có 8g Br2 tham gia. Tính: a/ %(V) mỗi khí trong hh các khí đo ở đkc b/ Khối lượng sản phẩm thu được
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(\left\{{}\begin{matrix}n_{CH_4}=a\left(mol\right)\\n_{C_2H_4}=b\left(mol\right)\end{matrix}\right.\)\(\Rightarrow a + b = \dfrac{3,36}{22,4} = 0,15(1) \)
\(CH_4 + 2O_2 \xrightarrow{t^o} CO_2 + 2H_2O\\ C_2H_4 + 3O_2 \xrightarrow{t^o} 2CO_2 + 2H_2O\\ n_{CO_2} = a + 2b = \dfrac{4,48}{22,4} = 0,2(2)\)
Từ (1)(2) suy ra: a = 0,1 ; b = 0,05
Suy ra:
\(\%V_{CH_4} = \dfrac{0,1}{0,15}.100\% = 66,67\%\\ \%V_{C_2H_4} = 100\% - 66,67\% = 33,33\%\)
b)
\(C_2H_4 + Br_2 \to C_2H_4Br_2\\ n_{Br_2} = n_{C_2H_4} = 0,05(mol)\\ \Rightarrow m_{Br_2} = 0,05.160 = 8\ gam\)

\(m_{Br_2}=m_{C_2H_4}=5,6g\)
\(\Rightarrow n_{C_2H_4}=\dfrac{5,6}{28}=0,2mol\)
\(n_{hh}=\dfrac{11,2}{22,4}=0,5mol\)
\(\Rightarrow n_{C_2H_6}=0,5-0,2=0,3mol\)
a)\(\%V_{C_2H_4}=\dfrac{0,2}{0,5}\cdot100\%=40\%\)
\(\%V_{C_2H_6}=100\%-40\%=60\%\)
b)\(m_{ddBr_2}=\dfrac{5,6}{8\%}\cdot100\%=70g\)

a, Ta có \(n_{CH_4}+n_{C_2H_4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\left(1\right)\)
PT: \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
\(C_2H_4+3O_2\underrightarrow{t^o}2CO_2+2H_2O\)
Theo PT: \(n_{O_2}=2n_{CH_4}+3n_{C_2H_4}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{CH_4}=0,05\left(mol\right)\\n_{C_2H_4}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}V_{CH_4}=0,05.22,4=1,12\left(l\right)\\V_{C_2H_4}=0,1.22,4=2,24\left(l\right)\end{matrix}\right.\)
b, \(m_{CH_4}=0,05.16=0,8\left(g\right)\)
c, \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Theo PT: \(n_{Br_2}=n_{C_2H_4}=0,1\left(mol\right)\Rightarrow V_{ddBr_2}=\dfrac{0,1}{1}=0,1\left(l\right)\)
\(m_{C_2H_4}=0,1.28=2,8\left(g\right)\)

\(n_{CO_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Đặt \(\left\{{}\begin{matrix}n_{CH_4}=x\\n_{C_2H_4}=y\end{matrix}\right.\) ( mol ) \(\Rightarrow m_{hh}=16x+28y=6\left(g\right)\) (1)
\(CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\)
x x ( mol )
\(C_2H_4+3O_2\rightarrow\left(t^o\right)2CO_2+2H_2O\)
y 2y ( mol )
\(n_{CO_2}=x+2y=0,4\left(mol\right)\) (2)
\(\left(1\right);\left(2\right)\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
\(\%m_{CH_4}=\dfrac{0,2.16}{6}.100=53,33\%\)
\(\%m_{C_2H_4}=100-53,33=46,67\%\)
\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
0,1 0,1 ( mol )
\(m_{Br_2}=0,1.160=16\left(g\right)\)

Gọi số mol C2H4, C2H2 là a, b (mol)
=> a + b = \(\dfrac{13,44}{22,4}=0,6\) (1)
nBr2 = 0,8.1 = 0,8 (mol)
PTHH: C2H4 + Br2 --> C2H4Br2
a----->a
C2H2 + 2Br2 --> C2H2Br4
b----->2b
=> a + 2b = 0,8 (2)
(1)(2) => a = 0,4 (mol); b = 0,2 (mol)
=> \(\left\{{}\begin{matrix}\%V_{C_2H_4}=\dfrac{0,4}{0,6}.100\%=66,67\%\\\%V_{C_2H_2}=\dfrac{0,2}{0,6}.100\%=33,33\%\end{matrix}\right.\)

\(m_Q=\left(7,7.2\right).0,1=1,54\left(g\right)\)
=> mT = 1,54 (g)
Gọi \(\left\{{}\begin{matrix}n_{CH_4}=a\left(mol\right)\\n_{C_2H_4}=b\left(mol\right)\\n_{H_2}=c\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}a+b+c=0,11\left(1\right)\\16a+28b+2c=1,54\left(2\right)\end{matrix}\right.\)
ngiảm = nH2(pư) = 0,11 - 0,1 = 0,01 (mol)
\(n_{Br_2}=\dfrac{4,8}{160}=0,03\left(mol\right)\)
Bảo toàn liên kết: b = 0,01 + 0,03 = 0,04 (mol) (3)
(1)(2)(3) => a = 0,02 (mol); b = 0,04 (mol); c = 0,05 (mol)
=> nH2(Q) = 0,05 - 0,01 = 0,04 (mol)
=> \(\%V_{H_2}=\dfrac{0,04}{0,1}.100\%=40\%\)

a, \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
\(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
Ta có: \(n_{C_2H_4}+n_{C_2H_2}=\dfrac{0,56}{22,4}=0,025\left(mol\right)\left(1\right)\)
Theo PT: \(n_{Br_2}=n_{C_2H_4}+2n_{C_2H_2}=\dfrac{5,6}{160}=0,035\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{C_2H_4}=0,015\left(mol\right)\\n_{C_2H_2}=0,01\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}V_{C_2H_4}=0,015.22,4=0,336\left(l\right)\\V_{C_2H_2}=0,01.22,4=0,224\left(l\right)\end{matrix}\right.\)
b, \(V_{ddBr_2}=\dfrac{0,035}{0,2}=0,175\left(l\right)\)

Đáp án D
« Nhận xét “tinh tế”: 0,12 mol Br2 sẽ phản ứng với 0,12 mol pC=C trong X.
® Nếu thay 0,12 mol Br2 bằng 0,12 mol H2 thì sẽ thu được X gồm các hiđrocacbon no và H2.
® Thực hiện thì lúc này có 6,56 gam hỗn hợp X dạng CnH2n + 2 (trường hợp H2 ứng với n = 0).
Giả sử khối lượng 0,1 mol X gấp k lần 6,32 gam X. Thêm 0,12k mol H2 vào các nối đôi C=C trong 0,1 mol X không làm thay đổi số mol X, chỉ thay đổi số H và khối lượng X mà thôi.
« Giải đốt:
![]()
Biết luôn số mol H2O vì lúc này tương quan đốt:
![]()
Bảo toàn C, H ta có
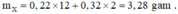
6 , 56 ÷ 3 , 28 = 2 ® tương ứng k = 0,5; nghĩa là lượng 0,12k mol H2 là 0,06 mol.
Theo đó:
![]()


Ta có Cùng điều kiện -> Quy số lít về số mol.n(hh ban đầu) = 20 mol; n(hh sau) = 16 lít
=> H2 phản ứng mất 4 lít => C2H2 có 2 lít và CH4 có 8 lít