Đốt cháy hoàn toàn 3,9 gam hỗn hợp M gồm hai hiđrocacbon kế tiếp nhau trong cùng dãy đồng
đẳng cần dùng vừa đủ 10,64 lít O2 (đktc). Hấp thụ hoàn toàn sản phẩm cháy vào 200 ml dung dịch
Ba(OH)2 1M, thu được dungg dịch có khối lượng giảm m gam so với khối lượng dung dịch Ba(OH)2
ban đầu.
a) Tính giá trị của m.
b) Xác định công thức phân tử của hai hiđrocacbon.
c) Tính phần trăm khối lượng của mỗi chất trong M
K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.
Những câu hỏi liên quan

2 tháng 3 2022
a) Gọi \(\left\{{}\begin{matrix}n_{CO_2}=a\left(mol\right)\\n_{H_2O}=b\left(mol\right)\end{matrix}\right.\)
=> 44a + 18b = 41,7 (1)
Bảo toàn C: nC = a (mol)
Bảo toàn H: nH = 2b (mol)
=> 12a + 2b = 8,9 (2)
(1)(2) => a = 0,6 (mol); b = 0,85 (mol)
Bảo toàn O: \(n_{O_2}=\dfrac{0,6.2+0,85}{2}=1,025\left(mol\right)\)
=> V = 1,025.22,4 = 22,96 (l)
b) Do \(n_{CO_2}< n_{H_2O}\)
=> 2 hidrocacbon là ankan
nankan = 0,85 - 0,6 = 0,25 (mol)
=> \(\overline{C}=\dfrac{0,6}{0,25}=2,4\)
=> 2 ankan là C2H6 và C3H8




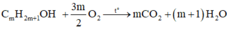
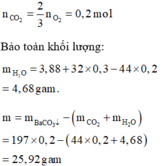

a) Gọi \(\left\{{}\begin{matrix}n_{CO_2}=a\left(mol\right)\\n_{H_2O}=b\left(mol\right)\end{matrix}\right.\)
\(n_{O_2}=\dfrac{10,64}{22,4}=0,475\left(mol\right)\)
Theo ĐLBTKL: \(44a+18b=3,9+0,475.32=19,1\left(g\right)\) (1)
Bảo toàn O: \(2a+b=0,95\left(mol\right)\left(2\right)\)
(1)(2) => a = 0,25; b = 0,45
\(n_{Ba\left(OH\right)_2}=0,2.1=0,2\left(mol\right)\)
PTHH: Ba(OH)2 + CO2 --> BaCO3 + H2O
0,2------>0,2------>0,2
BaCO3 + CO2 + H2O --> Ba(HCO3)2
0,05<--0,05
=> \(m_{BaCO_3}=\left(0,2-0,05\right).197=29,55\left(g\right)\)
\(m=m_{BaCO_3}-m_{CO_2}-m_{H_2O}=29,55-19,1=10,45\left(g\right)\)
b) Do \(n_{CO_2}< n_{H_2O}\)
=> 2 hidrocacbon là ankan
nankan = 0,45 - 0,25 = 0,2 (mol)
=> \(\overline{M}=\dfrac{3,9}{0,2}=19,5\left(g/mol\right)\)
Mà 2 ankan kế tiếp nhau
=> 2 ankan là CH4, C2H6
c) Đặt \(\left\{{}\begin{matrix}n_{CH_4}=x\left(mol\right)\\n_{C_2H_6}=y\left(mol\right)\end{matrix}\right.\)
=> x + y = 0,2
Bảo toàn C: x + 2y = 0,25
=> x = 0,15; y = 0,05
=> \(\left\{{}\begin{matrix}\%m_{CH_4}=\dfrac{0,15.16}{3,9}.100\%=61,54\%\\\%m_{C_2H_6}=\dfrac{0,05.30}{3,9}.100\%=38,46\%\end{matrix}\right.\)