nung hoàn toàn 24,5g kaliclorat
a.viết PTHH
b.tính thể tích khi khí Oxi thu được (đktc)
c.đốt 11,2g sắt trong lượng khí Oxi thu được ở trên. Tính khối lượng sản phẩm sinh ra
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a.\(n_{KMnO_4}=\dfrac{m}{M}=\dfrac{31,6}{158}=0,2mol\)
\(PTHH:2KMnO_4\underrightarrow{np}K_2MnO_4+MnO_2+O_2\)
2 1 1 1 ( mol )
0,2 0,1
\(V_{O_2}=n.22,4=0,1.22,4=2,24l\)
b.\(n_{Fe}=\dfrac{m}{M}=\dfrac{11,2}{56}=0,2mol\)
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
3 2 1 ( mol )
0,2 0,1
0,1 0,1 0,05 ( mol )
\(m_{Fe_3O_4}=n.M=0,05.232=11,6g\)

nKMnO4 = 9,48/158 = 0,06 (mol)
PTHH: 2KMnO4 -> (t°) K2MnO4 + MnO2 + O2 (p/ư phân hủy)
nO2 = 0,06/2 = 0,03 (mol)
nFe = 11,2/56 = 0,2 (mol)
PTHH: 3Fe + 2O2 -> (t°) Fe3O4
LTL: 0,2/3 > 0,03/4 => Fe dư
nFe3O4 = 0,03 : 2 = 0,015 (mol)
mFe3O4 = 0,015 . 232 = 3,48 (g)

a. \(n_{KClO_3}=\dfrac{24,5}{122,5}=0,2\left(mol\right)\)
PTHH : 2KClO3 -to> 2KCl + 3O2
0,2 0,3
\(V_{O_2}=0,3.22,4=6,72\left(l\right)\)
b.\(n_{O_2}=0,3\left(mol\right)\left[cmt\right]\)
\(m_{O_2}=0,3.32=9,6\left(g\right)\)
PTHH : 3Fe + 2O2 -to> Fe3O4
Theo ĐLBTKL
\(m_{Fe}+m_{O_2}=m_{Fe_3O_4}\\ \Rightarrow11,2+9,6=20,8\left(g\right)\)
a: \(2KClO_3\rightarrow2KCl+3O_2\)
\(n_{KClO_3}=\dfrac{24.5}{122.5}=0.2\left(mol\right)\)
\(\Leftrightarrow n_{O_2}=\dfrac{3}{2}\cdot0.2=0.3\left(mol\right)\)
\(V_{O_2}=0.3\cdot22.4=6.72\left(lít\right)\)
b: \(4Fe+3O_2\rightarrow2Fe_2O_3\)
\(n_{Fe}=\dfrac{11.2}{56}=0.2\left(mol\right)\)
\(\dfrac{n_{Fe}}{4}=\dfrac{0.2}{4}=0.05< \dfrac{n_{O_2}}{3}\) nên O2 dư
=>Tính theo Fe
\(n_{Fe_2O_3}=0.1\left(mol\right)\)
\(m_{Fe_2O_3}=0.1\cdot160=16\left(g\right)\)

a.b.
\(n_{Fe}=\dfrac{16,8}{56}=0,3mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,3 0,2 0,1 ( mol )
\(m_{Fe_3O_4}=0,1.232=23,2g\)
\(V_{O_2}=0,2.22,4=4,48l\)
\(V_{kk}=4,48.5=22,4l\)
c.
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
0,4 0,2 ( mol )
\(m_{KMnO_4}=\dfrac{0,4.158}{\left(100-20\right)\%}=79g\)
a/ Số mol Fe là : nFe = 16,8: 56 = 0,3 mol
PTPƯ:
3Fe + 2O2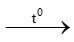 Fe3O4 (1)
Fe3O4 (1)
0,3 mol → 0,2mol → 0,1 mol
Từ (1) ta có số mol Fe3O4 = 0,1mol
→ m Fe3O4 = n.M = 0,1.232 = 23,2gam
b/ Từ (1) ta có số mol O2 đã dùng nO2 = 0,2 mol
Thể tích khí oxi đã dùng ở đktc: VO2 = n.22,4 = 0,2.22,4 = 4,48 lít
Thể tích không khí đã dùng: Vkk = 5. VO2= 5.4,48 = 22,4 lít.
c/ PTPƯ
2 KMnO4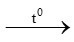 K2MnO4 + MnO2 + O2 (2)
K2MnO4 + MnO2 + O2 (2)
0,4444mol ← 0,222mol
Vì lượng Oxi thu được hao hụt 10% nên số mol O2 cần có là:
nO2 = 0,2mol.100/90 = 0.222 mol
Từ (2) ta có số mol KMnO4 = 0,444mol
Khối lượng KMnO4 bị nhiệt phân
mKMnO4 = n.M = 0,444.158 = 70.152 gam

a)\(n_{Al}=\dfrac{21,6}{27}=0,8\left(m\right)\)
\(PTHH:4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
tỉ lệ :4 3 2
số mol :0,8 0,6 0,4
\(V_{O_2}=0,6.22,4=13,44\left(g\right)\)
b)\(m_{Al_2O_3}=0,4.102=40,8\left(g\right)\)
c)\(PTHH:2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
tỉ lệ : 2 2 3
số mol :0,4 0,4 0,6
\(m_{KClO_3}=0,4.122,5=49\left(g\right)\)

a)
\(4P + 5O_2 \xrightarrow{t^o} 2P_2O_5\)
Sản phẩm : Điphotpho pentaoxit.
b)
\(n_P = \dfrac{6,2}{31} = 0,2(mol)\\ \Rightarrow n_{P_2O_5} = \dfrac{1}{2}n_P = 0,1(mol)\\ \Rightarrow m_{P_2O_5} = 0,1.142 = 14,2(gam)\)
c)
\(n_{O_2} = \dfrac{5}{4}n_P = 0,125(mol)\\ \Rightarrow V_{O_2} = 0,125.22,4 = 2,8(lít)\)
d)
\(V_{không\ khí} = \dfrac{2,8}{20\%} = 14(lít)\)

\(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\)
\(PTHH:3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\\ Mol:0,4\rightarrow\dfrac{4}{15}\rightarrow\dfrac{2}{15}\)
\(\rightarrow\left\{{}\begin{matrix}V_{O_2}=\dfrac{4}{15}.22,4=\dfrac{448}{75}\left(l\right)\rightarrow V_{kk}=\dfrac{448}{75}.5=\dfrac{448}{15}\left(l\right)\\m_{Fe_3O_4}=\dfrac{2}{15}.232=\dfrac{464}{15}\left(g\right)\end{matrix}\right.\)
2KClO3 --to--> 2KCl + 3O2
\(\dfrac{8}{45}\) \(\dfrac{4}{15}\)
\(m_{KClO_3}=\dfrac{8}{45}.122,5=\dfrac{196}{9}\left(g\right)\)
a, \(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\)
PTHH: 3Fe + 2O2 ---to---> Fe3O4
Mol: 0,4 \(\dfrac{0,8}{3}\) \(\dfrac{0,4}{3}\)
b, \(V_{O_2}=\dfrac{0,8}{3}.22,4=5,973\left(l\right)\)
c, \(V_{kk}=\dfrac{448}{75}.5=29,867\left(l\right)\)
d, \(m_{Fe_3O_4}=\dfrac{0,4}{3}.232=30,93\left(g\right)\)
e,
PTHH: 2KClO3 ---to---> 2KCl + 3O2
Mol: \(\dfrac{0,16}{9}\) \(\dfrac{0,8}{3}\)
\(m_{KClO_3}=\dfrac{0,16}{9}.122,5=2,178\left(g\right)\)

$a\big)$
$n_{Fe}=\frac{16,8}{56}=0,3(mol)$
$3Fe+2O_2\xrightarrow{t^o}Fe_3O_4$
Theo PT: $n_{Fe_3O_4}=\frac{1}{3}n_{Fe}=0,1(mol)$
$\to m_{Fe_3O_4}=0,1.232=23,2(g)$
$b\big)$
Theo PT: $n_{O_2}=\frac{2}{3}n_{Fe}=0,2(mol)$
$\to V_{O_2}=0,2.22,4=4,48(l)$
$\to V_{kk}=4,48.5=22,4(l)$
$c\big)$
$2KMnO_4\xrightarrow{t^o}K_2MnO_4+MnO_2+O_2$
Theo PT: $n_{KMnO_4}=2n_{O_2}=0,4(mol)$
$\to m_{KMnO_4(dùng)}=\frac{0,4.158}{80\%}=79(g)$
a, \(n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\)
PTHH: 3Fe + 2O2 ---to→ Fe3O4
Mol: 0,3 0,2 0,1
\(m_{Fe_3O_4}=0,1.232=23,2\left(g\right)\)
b, \(V_{O_2}=0,2.22,4=4,48\left(l\right)\Rightarrow V_{kk}=4,48.5=22,4\left(l\right)\)
c,
PTHH: 2KMnO4 ---to→ K2MnO4 + MnO2 + O2
Mol: 0,4 0,2
\(m_{KMnO_4\left(lt\right)}=0,4.158=63,2\left(g\right)\)
\(\Rightarrow m_{KMnO_4\left(tt\right)}=\dfrac{63,2}{80\%}=79\left(g\right)\)

a) 3Fe + 2O2 Fe3O4
b) nFe = \(\dfrac{8,4}{56}\)= 0,15 mol
nFe3O4 = \(\dfrac{11,6}{232}\) = 0,05 mol
Ta thấy \(\dfrac{nFe}{3}\)= \(\dfrac{nFe_3O_4}{1}\)=> Fe phản ứng hết
<=> nO2 cần dùng = \(\dfrac{2nFe}{3}\)= 0,1 mol
<=> mO2 cần dùng = 0,1.32 = 3,2 gam
c) Oxi chiếm thể tích bằng 1/5 thể tích không khí.
Mà V O2 = 0,1.22,4 = 2,24 lít => V không khí = 2,24 . 5 = 11,2 lít
\(n_{KClO_3}=\dfrac{24,5}{122,5}=0,2mol\)
a)\(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
0,2 0,3
b)\(V_{O_2}=0,3\cdot22,4=6,72l\)
c)Bảo toàn khối lượng:
\(m_{Fe}+m_{O_2}=m_{sp}\)
\(\Rightarrow m_{sp}=11,2+0,3\cdot32=20,8g\)