Đốt cháy 14,2(g) P trong khí Oxi a.viết PTHH.cho biết phản ứng trên thuộc loại phản ứng nào b.tính khối lượng sản phẩm sinh ra
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

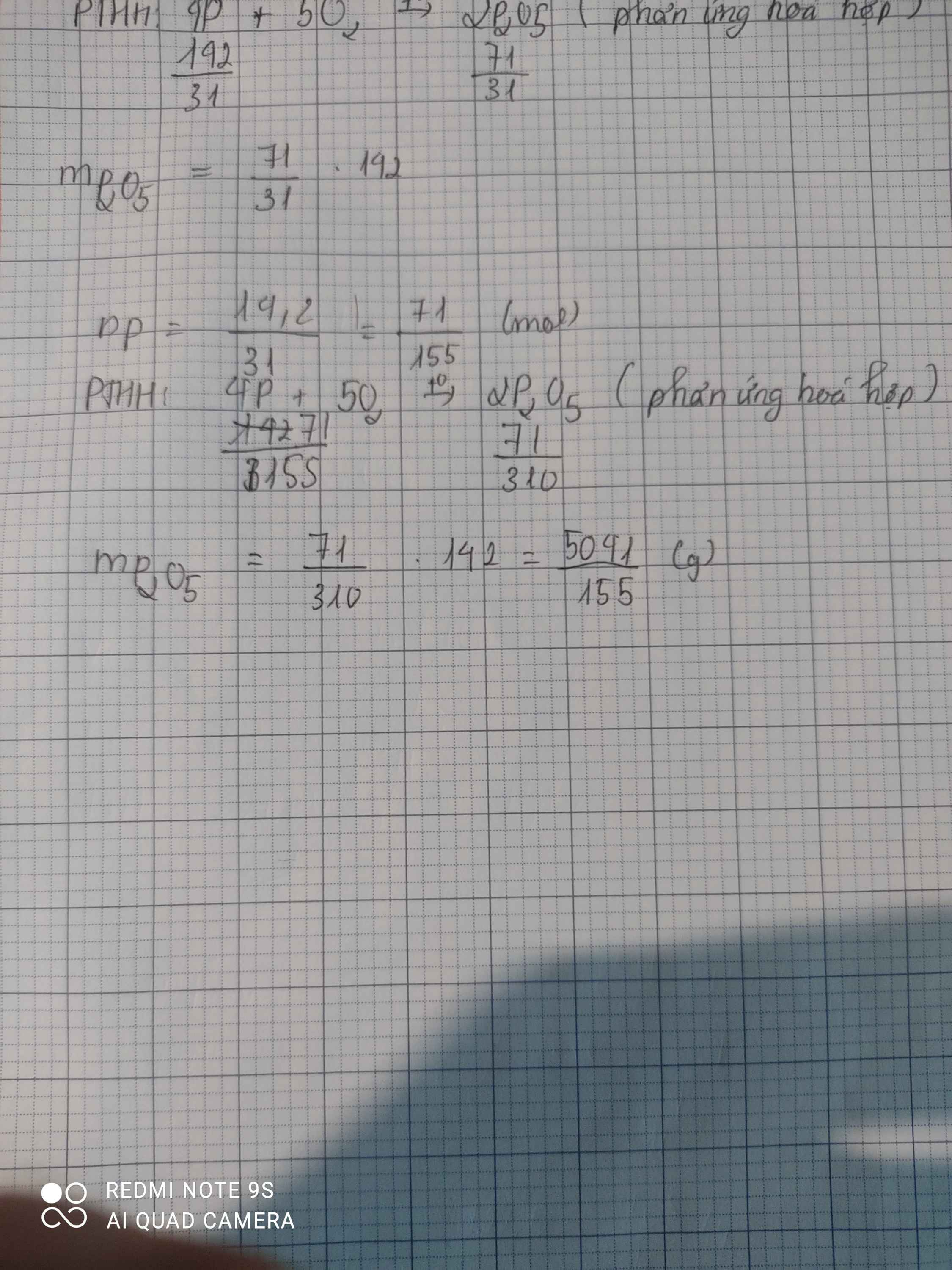

a.\(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
Phản ứng trên thuộc loại phản ứng phân hủy
b.\(n_{KClO_3}=\dfrac{m_{KClO_3}}{M_{KClO_3}}=\dfrac{17,15}{122,5}=0,14mol\)
\(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
2 2 3 ( mol )
0,14 0,21
\(V_{O_2}=m_{O_2}.22,4=0,21.22,4=4,704l\)
c. \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
3 2 1 ( mol )
0,315 0,21 ( mol )
\(m_{Fe}=n_{Fe}.M_{Fe}=0,315.56=17,64g\)
d.\(n_P=\dfrac{m_P}{M_P}=\dfrac{6,2}{31}=0,2mol\)
\(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
4 5 2 ( mol )
0,2 > 0,21 ( mol )
0,21 0,084 ( mol )
\(m_{P_2O_5}=n_{P_2O_5}.M_{P_2O_5}=0,084.142=11,928g\)

a, \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_{3\downarrow}+H_2O\)
b, Ta có: \(n_{CH_4}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PT: \(n_{CaCO_3}=n_{CO_2}=n_{CH_4}=0,3\left(mol\right)\)
\(\Rightarrow m_{CaCO_3}=0,3.100=30\left(g\right)\)
Thúy Ngọc
Đề không cho điều kiện gì hả bạn? Nhưng như đề trên thì khả năng cao là đktc vì cho số mol đẹp.

\(n_{H_2}=\dfrac{V}{24,79}=\dfrac{4,48}{24,79}\approx0,2\left(mol\right)\)
\(a.PTHH:2H_2+O_2\underrightarrow{t^o}2H_2O\) \(\rightarrow\) Phản ứng hóa hợp.
2 1 2
0,2 0,1 0,2
b. \(V_{O_2}=n.24,79=0,1.24,79=2,479\left(l\right)\\ m_{H_2O}=n.M=0,2.\left(2+16\right)=3,6\left(g\right).\)
\(a.2H_2+O_2\underrightarrow{t^o}2H_2O\)(PỨ hoá hợp)
b. Số mol của 4,48 lít khi hidro là:
\(n_{H_2}=\dfrac{V}{22,4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Thể tích Oxi cần dùng là:
\(V_{O_2}=n.22,4=0,1.22,4=2,24\left(l\right)\)
Khối lượng nước là:
\(m_{H_2O}=n.M=0,2.18=3,6\left(g\right)\)

\(a,PTHH:2Cu+O_2\xrightarrow{t^o}2CuO\\ n_{Cu}=\dfrac{11,52}{64}=0,18(mol)\\ b,n_{CuO}=n_{Cu}=0,18(mol)\\ \Rightarrow m_{CuO}=0,18.80=14,4(g)\\ c,n_{O_2}=0,5.n_{Cu}=0,09(mol)\\ \Rightarrow V_{O_2}=0,09.22,4=2,016(l)\\ \Rightarrow V_{kk}=2,016.5=10,08(l)\)

a, nZn = 13/65 = 0,2 (mol)
PTHH: 2Zn + O2 -> (t°) 2ZnO
Mol: 0,2 ---> 0,1 ---> 0,2
b, VO2 = 0,1 . 22,4 = 2,24 (l)
c, mZnO = 0,2 . 81 = 16,2 (g)
d, PTHH: 2KMnO4 -> (t°) K2MnO4 + MnO2 + O2
nKMnO4 = 0,1 . 2 = 0,2 (mol)
mKMnO4 = 0,2 . 158 = 31,6 (g)

nO2 = 3,36 : 22,4 = 0,15 (mol)
pthh : 2Mg + O2 -t--> 2MgO
0,3<----0,15---> 0,3 (mol)
=> mMg= 0,3 . 24 = 7,2 (g)
=> mMgO = 0,3 . 40 =12 (g)
pthh : 2KMnO4 -t--> K2MnO4 + MnO2 + O2
0,3<-------------------------------------0,15 (mol)
=> mKMnO4 = 0,3 . 158 = 47,4 (g)

a) \(4Al+3O_2->2Al_2O_3\)
b) Ta có phản ứng : \(Al+O_2->Al_2O_3\)
Theo định luật bảo toàn khối lượng :
\(m_{Al}+m_{O_2}=m_{Al_2O_3}\)
c) Ta có: \(m_{Al}+m_{O_2}=m_{Al_2O_3}\)
=> 54g + \(m_{O_2}\) = 102 g
=> \(m_{O_2}\) = 48( g)
a/ PTHH: 4Al + 3O2 ===> 2Al2O3
b/ Áp dụng định luật bảo toàn khối lượng, ta có:
mAl + mO2 = mAl2O3
c/ Theo phần b,
=> mO2 = mAl2O3 - mAl = 102 - 54 = 48 gam


