cho 2,66 gam hỗn hợp MgO FeO Fe2O3 tác dụng với V ml dung dịch H2SO4 0,1M sau phản ứng thu được 6,66 gam muối.Lập phương trình hoá học của các phản ứng và tính V
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{HCl}=0,1.0,3=0,03\left(mol\right)\)
=> \(n_{H_2O}=\dfrac{0,03}{2}=0,015\left(mol\right)\)
Theo ĐLBTKL: \(m_{oxit}+m_{HCl}=m_{muối}+m_{H_2O}\)
=> mmuối = 3,425 + 0,03.36,5 - 0,015.18 = 4,25(g)

Câu 3:
Gọi x, y lần lượt là số mol của MgO và Al2O3
Ta có: \(n_{H_2SO_4}=0,2.250:1000=0,05\left(mol\right)\)
a. PTHH:
MgO + H2SO4 ---> MgSO4 + H2O (1)
Al2O3 + 3H2SO4 ---> Al2(SO4)3 + 3H2O (2)
b. Theo PT(1): \(n_{H_2SO_4}=n_{MgO}=x\left(mol\right)\)
Theo PT(2): \(n_{H_2SO_4}=3.n_{Al_2O_3}=3y\left(mol\right)\)
=> x + 3y = 0,05 (1)
Theo đề, ta có: 40x + 102y = 1,82 (2)
Từ (1) và (2), ta có HPT:
\(\left\{{}\begin{matrix}x+3y=0,05\\40x+102y=1,82\end{matrix}\right.\)
=> x = 0,02, y = 0,01
=> \(m_{MgO}=0,02.40=0,8\left(mol\right)\)
=> \(\%_{m_{MgO}}=\dfrac{0,8}{1,82}.100\%=43,96\%\)
\(\%_{m_{Al_2O_3}}=100\%-43,96\%=56,04\%\)
Câu 4:
Ta có: \(m_{H_2SO_4}=\dfrac{19,6\%.100\%}{100}=19,6\left(g\right)\)
=> \(n_{H_2SO_4}=\dfrac{19,6}{98}=0,2\left(mol\right)\)
Ta lại có: \(n_{CuO}=\dfrac{8}{80}=0,1\left(mol\right)\)
a. PTHH: CuO + H2SO4 ---> CuSO4 + H2O
Ta thấy: \(\dfrac{0,1}{1}< \dfrac{0,2}{1}\)
Vậy H2SO4 dư.
Theo PT: \(n_{CuSO_4}=n_{CuO}=0,1\left(mol\right)\)
=> \(m_{CuSO_4}=0,1.160=16\left(g\right)\)
Ta có: \(m_{dd_{CuSO_4}}=8+100=108\left(g\right)\)
=> \(C_{\%_{CuSO_4}}=\dfrac{16}{108}.100\%=14,81\%\)
Câu 5: Thiếu đề

Theo định luật bảo toàn khối lượng ta có:
m 3 o x i t + m H 2 S O 4 = m m u ố i + m H 2 O s a n p h a m
⇔ m m u ố i = m 3 o x i t + m H 2 S O 4 - m H 2 O s a n p h a m
Mà n H 2 O san pham = n H 2 S O 4 = 1.0,05 = 0,05 mol
⇒ m m u o i = 2,8 + 0,05.98 - 0,05.18 = 6,8g
⇒ Chọn C.

a, Ta có: $n_{O}=0,6(mol)$
Suy ra $n_{H^+/pu}=1,2(mol)\Rightarrow n_{H_2SO_4}=0,6(mol)$
Bảo toàn khối lượng ta có: $m_{muoi}=29,6+0,6.96=87,2(g)$

\(n_{H2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
a) \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\)
b) \(n_{Fe}=n_{H2}=n_{H2SO4}=0,1\left(mol\right)\Rightarrow m_{Fe}=0,1.56=5,6\left(g\right)\)
\(\Rightarrow m_{Al2O3}=15,8-5,6=10,2\left(g\right)\)
c) Ta có : \(n_{Al2O3}=\dfrac{10,2}{102}=0,1\left(mol\right)\Rightarrow n_{H2SO4}=3n_{Al2O3}=0,3\left(mol\right)\)
\(C_{MddH2SO4}=\dfrac{0,1+0,3}{0,2}=2M\)

a, PT: \(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\(FeO+H_2SO_4\rightarrow FeSO_4+H_2O\)
Gọi: \(\left\{{}\begin{matrix}n_{CuO}=x\left(mol\right)\\n_{FeO}=y\left(mol\right)\end{matrix}\right.\) ⇒ 80x + 72y = 11,2 (1)
Ta có: \(n_{H_2SO_4}=0,15.1=0,15\left(mol\right)\)
Theo PT: \(n_{H_2SO_4}=n_{CuO}+n_{FeO}=x+y=0,15\left(2\right)\)
Từ (1) và (2) ⇒ x = 0,05 (mol), y = 0,1 (mol)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CuO}=\dfrac{0,05.80}{11,2}.100\%\approx35,71\%\\\%m_{FeO}\approx64,28\%\end{matrix}\right.\)
b, Theo PT: \(\left\{{}\begin{matrix}n_{CuSO_4}=n_{Cu}=0,05\left(mol\right)\\n_{FeSO_4}=n_{FeO}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{CuSO_4}}=\dfrac{0,05}{0,15}=\dfrac{1}{3}\left(M\right)\\C_{M_{FeSO_4}}=\dfrac{0,1}{0,15}=\dfrac{2}{3}\left(M\right)\end{matrix}\right.\)

$n_{SO_2}=\dfrac{2,24}{22,4}=0,1(mol)$
Quy hỗn hợp về $Fe:x(mol),O:y(mol)$
$\to 56x+16y=30,4(1)$
Bảo toàn e: $3n_{Fe}=2n_O+2n_{SO_2}$
$\to 3x=2y+0,2(2)$
Từ $(1)(2)\to x=0,4(mol);y=0,5(mol)$
Bảo toàn Fe: $n_{Fe_2(SO_4)_3}=0,5x=0,2(mol)$
$\to m_X=0,2.400=80(g)$

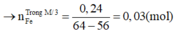

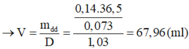
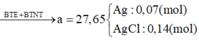
\(MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
\(FeO+H_2SO_4\rightarrow FeSO_4+H_2O\)
\(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
Có nH2O = nH2SO4 = a (mol)
Theo ĐLBTKL: 2,66 + 98a = 6,66 + 18a
=> a = 0,05 (mol)
=> \(V_{ddH_2SO_4}=\dfrac{0,05}{0,1}=0,5\left(l\right)=500\left(ml\right)\)