Giúp tớ với được không?
Cho 20g Cu vào cốc đựng 0,5l dung dịch AgNO3 0,3M. Khuấy đều sau một thời gian lọc thì thu được 29,12g chất rắn và dung dịch A
a, tính nồng độ mol các chất trong dung dịch A ( biết V không đổi)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
nCu = 0,125
Dung dịch B chỉ chứa 1 muối duy nhất là muối Pb(NO3)2


Đáp án B
Cu + 2 Ag + → Cu 2 + + 2 Ag
mchất rắn tăng = nCu.(2.108-64)=152.nCu
=> nCu phản ứng = 0,01 mol = n Cu 2 +
=> n Ag + phản ứng = 0 , 02 ( mol )
A gồm 0,01 mol Cu2+ và Ag+ dư.
B chỉ chứa 1 muối duy nhất là muối Pb2+
Tương tự:
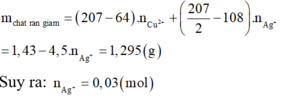
Vậy tổng số mol Ag+ là 0,05 (mol)

a) m rắn=4,08 gam
b) CM Cu(NO3)2 dư=0,35M; CM Fe(NO3)2=0,2M
c) V NO2=1,792 lít
Giải thích các bước giải:
Ta có: nAgNO3=0,2.0,1=0,02 mol; nCu(NO3)2=0,5.0,2=0,1 mol; nFe=2,24/56=0,04 mol
Fe + 2AgNO3 -> Fe(NO3)2 + 2Ag
Vì nAgNO3=0,02 mol; nFe =0,04 -> Fe dư -> tạo ra 0,02 mol Ag và Fe phản ứng 0,01 mol -> dư 0,03 mol
Fe + Cu(NO3)2 -> Fe(NO3)2 + Cu
Vì Cu(NO3)2=0,1 mol; nFe =0,03 mol -> Cu(NO3)2 dư =0,07 mol ; nCu=0,03 mol
Rắn thu được gồm Ag 0,02 mol và Cu 0,03 mol -> m rắn=4,08 gam
Dung dịch sau phản ứng chứa Cu(NO3)2 dư 0,07 mol và Fe(NO3)2 0,04 mol (Bảo toàn Fe)
-> CM Cu(NO3)2=0,07/0,2=0,35M; CM Fe(NO3)2=0,04/0,2=0,2M
Hòa tan rắn bằng HNO3 đặc
Ag + 2HNO3 -> AgNO3 + NO2 + H2O
Cu + 4HNO3 -> Cu(NO3)2 +2NO2 + 2H2O
-> nNO2=nAg + 2nCu=0,02+0,03.2=0,08 mol -> V NO2=0,08.22,4=1,792 lít


PTHH:
\(Cu+2AgNO_3\rightarrow Cu\left(NO_3\right)_2+2Ag\)
mKL tăng : \(mAg-mCu=29,12-20=9,12g\)
=>\(nCu=\dfrac{9,12}{108.2-64}=0,06mol\)
\(nAgNO_3=0,3.0,5=0,15mol\)
tỉ lệ so sánh :
\(\dfrac{nAgNO_3}{2}>\dfrac{nCu}{1}\left(0,075>0,06\right)\Leftrightarrow nAgNO_{3\left(dư\right)}=0,15-0,06.2=0,03mol\)
thep pt: \(nCu\left(NO_3\right)_2=nCu=0,06mol\)
\(\Leftrightarrow C_{MCu\left(NO_3\right)_2}=\dfrac{0,06}{0,5}=0,12M\)
\(C_{MAgNO_{3\left(dư\right)}}=\dfrac{0,03}{0,5}=0,06M\)
vậy nồng độ mol chất Cu(NO3)2 và AgNO3(dư) lần lượt là 0,12M và 0,06M