Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nH2 = 1,344 : 22,4 = 0,06(mol)
pthh 2M+ 3H2SO4 ---> M2(SO4)3+ 3H2
0,04<-- 0,06---------------------------0,06(mol)
M M = 1,08 : 0,04 = 27 (g/mol )
=> M : Al
mH2SO4 = 0,06.98 =5,88 (g)
nH2 = 1,344/22,4 = 0,06 (mol)
PTHH:
2M + 3H2SO4 -> Al2(SO4)3 + 3H2
0,04 <--- 0,06 <--- 0,02 <--- 0,06
M(M) = 1,08/0,04 = 27 (g/mol(
=> M là Al
mH2SO4 = 0,06 . 98 = 5,88 (g)

Gọi KL là R
\(n_{H_2}=\dfrac{13,44}{22,4}=0,6(mol)\\ a,2R+6HCl\to 2RCl_3+3H_2\\ \Rightarrow n_R=0,4(mol)\\ \Rightarrow M_R=\dfrac{10,8}{0,4}=27(g/mol)(Al)\\ b,n_{HCl}=1,2(mol)\\ \Rightarrow m_{dd_{HCl}}=\dfrac{1,2.36,5}{14,6\%}=300(g)\)

Gọi hóa trị của M là n.
Ta có: \(n_{H_2}=\dfrac{5,376}{22,4}=0,24\left(mol\right)\)
PT: \(2M+nH_2SO_4\rightarrow M_2\left(SO_4\right)_n+nH_2\)
Theo PT: \(n_M=\dfrac{2}{n}n_{H_2}=\dfrac{0,48}{n}\left(mol\right)\)
\(\Rightarrow M_M=\dfrac{15,6}{\dfrac{0,48}{n}}=\dfrac{65}{2}n\left(g/mol\right)\)
Với n = 2 thì MM = 65 (g/mol)
Vậy: M là Zn.

Gọi CTHH oxit kim loại là \(RO\)
Giả sử có 1mol oxit pứ
\(RO+H_2SO_4\rightarrow RSO_4+H_2O\)
\(1-\rightarrow1---\rightarrow1\)
\(m_{ddH_2SO_4}=\dfrac{1.98}{4,9}\cdot100=2000\left(g\right)\\ m_{ddRSO_4}=1\left(R+16\right)+2000=2016+R\left(g\right)\\ C_{\%RSO_4}=\dfrac{1\left(R+96\right)}{2016+R}\cdot100=5,88\%\\ \Rightarrow R\approx24\left(g/mol\right)\)
Vậy R là Mg

Câu 1
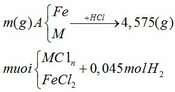
Áp dụng định luật bảo toàn nguyên
tố H ta có:
nHCl = 2nH2 = 2.0,045 = 0,09 mol
Áp dụng định luật bảo toàn khối lượng
ta có: mA + mHCl = m muối + mH2
=> m = m muối + mH2 – mA = 4,575 + 0,045.2 – 0,09.36,5 = 1,38 (gam)
Câu 2
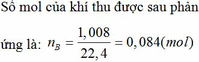
Do cho kim loại phản ứng với H2SO4 đặc và HNO3 đặc nên khí sinh ra là SO2 và NO2.
Áp dụng phương pháp đường chéo ta có:
SO2: 64 4,5
50,5
NO2: 46 13,5
→nSO2=nNO2=4,513,5=13
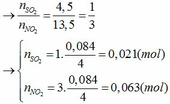
Đặt số mol của Fe và M lần lượt là x và y (mol)
- Khi cho hỗn hợp tác dụng với HCl:
Fe + 2HCl → FeCl2 + H2
x x (mol)
M + nHCl → MCln + 0,5nH2
y 0,5ny (mol)
nH2 = 0,045 => x + 0,5ny = 0,045 (1)
- Khi cho hỗn hợp tác dụng với HNO3 đặc và H2SO4 đặc:
Ta có các bán phản ứng oxi hóa – khử:
Fe → Fe3+ + 3e
x 3x
M → Mn+ + ne
y ny
S+6 + 2e → S+4 (SO2)
0,021 0,042
N+5 + 1e → N+4 (NO2)
0,063 0,063
Áp dụng định luật bảo toàn electron ta có: 3x + ny = 0,042 + 0,063 hay 3x + ny = 0,105 (2)
Từ (1) và (2) ta có hệ phương trình sau:
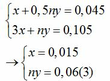
Mặt khác: mA = mFe + mM => 1,38 = 0,015.56 + My => My = 0,54(4)
Từ (3) và (4) suy ra M = 9n
Ta có bảng sau:
| n |
1 |
2 |
3 |
| M |
9 (loại) |
18 (loại) |
27 (nhận) |
Vậy kim loại M là nhôm, kí hiệu là Al.


BTKL: mD + mNaHCO3 = mCO2 + mE
mD + 179,88 = 44.0,2 + 492 => mD = 320,92
BTKL: mMg + mddHCl = mH2 + mD
=> 24 . 0,4 + mddHCl = 2 . 0,4 + 320,92 => mddHCl = 312,12
=> C%HCl = 11,69%
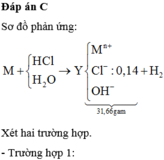

\(n_{H_2}=\dfrac{50.4}{22.4}=2.25\left(mol\right)\)
\(2M+2nH_2SO_4\rightarrow M_2\left(SO_4\right)_n+nH_2\)
\(\dfrac{4.5}{n}.............................2.25\)
\(M_M=\dfrac{54}{\dfrac{4.5}{n}}=12n\)
\(BL:n=2\Rightarrow M=24\)
\(M:Mg\)
\(n_{H_2SO_4}=n_{H_2}=2.25\left(g\right)\)
\(m_{dd_{H_2SO_4}}=\dfrac{2.25\cdot98\cdot100}{10}=2205\left(g\right)\)
Giả sử kim loại cần tìm là A có hóa trị n không đổi.
Ta có: \(n_{H_2}=\dfrac{50,4}{22,4}=2,25\left(mol\right)\)
BT e, có: \(n_A=\dfrac{2,25.2}{n}=\dfrac{4,5}{n}\left(mol\right)\)
\(\Rightarrow M_A=\dfrac{54}{\dfrac{4,5}{n}}=12n\)
Với n = 1 ⇒ MA = 12 (loại)
Với n = 2 ⇒ MA = 24 (nhận)
Vậy: A là Magie (Mg).
BTNT H có: \(n_{H_2SO_4}=n_{H_2}=2,25\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4}=2,25.98=220,5\left(g\right)\)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{220,5.100}{10}=2205\left(g\right)\)
Bạn tham khảo nhé!