cho 14,9 gam hỗn hợp Zn và Fe phản ứng vừa đủ với m gam dd HCL.10% cô cạn dung dịch sau phản ứng thu được 32,65 muối khan,giá trị của m là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án D.
Đặt nGly = a và nLysin = b ta có.
a + b = 0,18
a + 2b = 0,24
⇒ a = 0,12 và b = 0,06.
⇒ m hỗn hợp = 0,12×75 + 0,06×146 = 17,76.
Nhận thấy 17,76 × 1,5 = 26,64.
⇒ Trong 26,64 gam X chứa:
nGly = 0,18 và nLyysin = 0,09 mol.
Nhận thấy ∑nCOOH/X = 0,18 + 0,09 = 0,27 < nKOH = 0,3 mol.
⇒ KOH dư.
⇒ mMuối = 0,18×(75+38) + 0,09×(146+38) = 36,9 gam.

Đáp án D
Đặt nGly = a và nLysin = b ta có.
a + b = 0,18 || a + 2b = 0,24
⇒ a = 0,12 và b = 0,06.
⇒ m hỗn hợp = 0,12×75 + 0,06×146
= 17,76.
Nhận thấy 17,76 × 1,5 = 26,64
⇒ Trong 26,64 gam X chứa
nGly = 0,18 và nLyysin = 0,09 mol.
Nhận thấy:
∑nCOOH/X = 0,18 + 0,09 = 0,27
< nKOH = 0,3 mol ⇒ KOH dư.
⇒ mMuối = 0,18(75+38) + 0,09(146+38)
= 36,9 g ⇒ Chọn D.
Chú ý: Đề hỏi mMuối khan chứ không
hỏi mChất rắn.

\(\left\{{}\begin{matrix}n_{HCl}=0,2.4=0,8\left(mol\right)\\n_{HBr}=0,2.2=0,4\left(mol\right)\end{matrix}\right.\)
=> \(n_{H_2O}=0,6\left(mol\right)\)
=> nO = 0,6 (mol)
=> mkim loại = 34,8 - 0,6.16 = 25,2 (g)
=> mmuối = 25,2 + 0,8.35,5 + 0,4.80 = 85,6 (g)

Theo định luật bảo toàn khối lượng ta có:
m 3 o x i t + m H 2 S O 4 = m m u ố i + m H 2 O s a n p h a m
⇔ m m u ố i = m 3 o x i t + m H 2 S O 4 - m H 2 O s a n p h a m
Mà n H 2 O san pham = n H 2 S O 4 = 1.0,05 = 0,05 mol
⇒ m m u o i = 2,8 + 0,05.98 - 0,05.18 = 6,8g
⇒ Chọn C.

Tổng quát: H 2 N − R − C O O H + N a O H → H 2 N − R − C O O N a + H 2 O
Theo phương trình tổng quát: n H 2 O = n N a O H = 0 , 25.1 , 2 = 0 , 3 m o l
Bảo toàn khối lượng:
m a . a + m N a O H = m m u o i + ⇔ m + 0 , 3.40 = 31 , 62 + 0 , 3.18 ⇔ m = 25 , 02 g
Đáp án cần chọn là: D

Đáp án B
Tăng giảm khối lượng: m = 26,35 – 0,25 × 22 = 20,85 gam
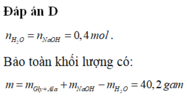
Phản ứng xảy ra:
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Có:
\(m_{\text{muối}}=m_{kl}+m_{Cl}\rightarrow32,65=14,9+m_{Cl}\)
\(\rightarrow m_{Cl}=17,75g\rightarrow n_{Cl}=0,5mol=n_{HCl}\)
\(\rightarrow m_{HCL}=0,5.36,5=18,25g\)
\(\rightarrow m=m_{ddHCl}=\frac{18,25}{10\%}=182,5g\)