Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Bài 1 :
a)
\(2Cu + O_2 \xrightarrow{t^o} 2CuO\)
b)
Ta có :
\(n_{Cu} = \dfrac{32}{64} = 0,5(mol)\)
Theo PTHH : \(n_{O_2} = 0,5n_{Cu} = 0,25(mol)\\ \Rightarrow V_{O_2} = 0,25.22,4 = 5,6(lít)\)
c) Ta có : \(n_{CuO} = n_{Cu} = 0,5(mol)\Rightarrow m_{CuO} = 0,5.80 = 40(gam)\)

từng bài một nhé
a) Phương trình hóa học : \(2Cu+O_2\rightarrow2CuO\)
b) Số mol Cu tham gia phản ứng :
\(n_{Cu}=\frac{m_{Cu}}{M_{Cu}}=\frac{32}{128}=0,25\left(mol\right)\)
Theo PTHH :
2 mol Cu tham gia phản ứng với 1 mol O2
=> 0, 25 mol Cu tham gia phản ứng với 0,125 mol O2
=> Thể tích khí O2 thu được ở đktc là :
\(V_{O_2}=n_{O_2}\cdot22,4=0,125\cdot22,4=2,8\left(l\right)\)
c) Theo PTHH
2 mol Cu tham gia phản ứng tạo thành 2 mol CuO
=> 0, 25 mol Cu tham gia phản ứng tạo thành 0, 25 mol CuO
=> Khối lượng CuO thu được là :
\(m_{CuO}=n_{CuO}\cdot M_{CuO}=0,25\cdot80=20\left(g\right)\)
xinloi mắc tí việc :v
Bài 2.
a) Phương trình hóa học : \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
b) Số mol Zn tham gia phản ứng :
\(n_{Zn}=\frac{m_{Zn}}{M_{Zn}}=\frac{13}{65}=0,2\left(mol\right)\)
Theo PTHH :
1 mol Zn tham gia phản ứng thu được 1 mol H2
=> 0, 2 mol Zn tham gia phản ứng thu được 0, 2 mol H2
=> Thể tích khí H2 thu được ở đktc là :
\(V_{H_2}=n_{H_2}\cdot22,4=0,2\cdot22,4=4,48\left(l\right)\)
b) Theo PTHH :
1 mol Zn tham gia phản ứng với 1 mol H2SO4
=> 0, 2 mol Zn tham gia phản ứng với 0, 2 mol H2SO4
=> Khối lượng H2SO4 tham gia phản ứng là :
\(m_{H_2SO_4}=n_{H_2SO_4}\cdot M_{H_2SO_4}=0,2\cdot98=19,6\left(g\right)\)

Bài 1 :
a) PTHH : \(2Cu+O_2-t^o->2CuO\)
b) \(n_{Cu}=\frac{32}{64}=0,5\left(mol\right)\)
Theo pthh : \(n_{O2}=\frac{1}{2}n_{Cu}=0,25\left(mol\right)\)
=> \(V_{O2}=0,25\cdot22,4=5,6\left(l\right)\)
c) Theo pthh : \(n_{CuO}=n_{Cu}=0,5\left(mol\right)\)
=> \(m_{CuO}=80\cdot0,5=40\left(g\right)\)
Bài 2 :
a) \(PTHH:Zn+H_2SO_4-->ZnSO_4+H_2\uparrow\)
b) \(n_{Zn}=\frac{13}{65}=0,2\left(mol\right)\)
Theo pthh : \(n_{H_2}=n_{Zn}=0,2\left(mol\right)\)
=> \(V_{H2}=0,2\cdot22,4=4,48\left(l\right)\)
c) Theo pthh : \(n_{H2SO4\left(pứ\right)}=n_{Zn}=0,2\left(mol\right)\)
=> \(m_{H2SO4\left(pứ\right)}=98\cdot0,2=19,6\left(g\right)\)

a, \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
b, \(n_{H_2}=\dfrac{2,8}{22,4}=0,125\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{1}{2}n_{H_2}=0,0625\left(mol\right)\Rightarrow V_{O_2}=0,0625.22,4=1,4\left(l\right)\)
\(n_{H_2O}=n_{H_2}=0,125\left(mol\right)\Rightarrow m_{H_2O}=0,125.18=2,25\left(g\right)\)
Số mol của 2,8 lít khí H2
nH2 = \(\dfrac{V}{22,4}\) = \(\dfrac{2,8}{22,4}\) = 0.125 mol
a. PTHH: 2H2 + O2 \(\rightarrow\) 2H2O
Tỉ lệ: 2 1 2
Mol: 0.125 \(\rightarrow\) 0.1 \(\rightarrow\) 0.125
b. Thể tích khí O2 ở đktc
VO2 = n . 22,4 = 0.1 . 22,4 = 2,24 (l)
Khối lượng H2O thu được
mH2O = n . M = 0.125 . 18 = 2,25g

\(a) Zn + 2HCl \to ZnCl_2 + H_2\\ n_{H_2} = n_{Zn} = \dfrac{13}{65} = 0,2(mol)\\ V_{H_2} = 0,2.22,4 = 4,48(lít)\\ b)n_{O_2} =\dfrac{4,8}{32}=0,15(mol)\\ 2H_2 + O_2 \xrightarrow{t^o} 2H_2O\\ \dfrac{n_{H_2}}{2} = 0,1 < \dfrac{n_{O_2}}{1} = 0,15 \to O_2\ dư\\ n_{H_2O} = n_{H_2} = 0,2(mol)\\ \Rightarrow m_{H_2O} = 0,2.18= 3,6(gam)\)

Đáp án D
Đặt Zn, Cr,Sn là x mol → ZnCl2 : x mol, SnCl2 : x mol và CrCl2 : x mol
→ x =0,02 mol
Bảo toàn O trong phương trình đốt cháy có 2nO2 = x + 2x + 3/2 x =0,09
→ VO2= 1,008 lít

a) \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
\(n_{HCl}=0,2.1=0,2\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
Xét tỉ lệ: \(\dfrac{0,2}{1}>\dfrac{0,2}{2}\) => Zn dư, HCl hết
PTHH: Zn + 2HCl --> ZnCl2 + H2
__________0,2-------------->0,1
=> VH2 = 0,1.22,4 = 2,24(l)
b)
PTHH: 2H2 + O2 --to--> 2H2O
______0,1->0,05
=> mO2 = 0,05.22,4 = 1,12 (l)

Bài 4. 2\(KMnO_4\) ---> \(K_2MnO_4\) + \(MnO_2\) + \(O_2\) (Lập và cân bằng phương trình)
0,6 mol 0,3 mol 0,3 mol 0,3 mol
a. + Số mol của \(O_2\)
\(n_{O_2}\) = \(\dfrac{V}{22,4}\) = \(\dfrac{6,72}{22,4}\) = 0,3 (mol)
+ Khối lượng của \(KMnO_4\) (thuốc tím) cần dùng:
\(m_{KMnO_4}\) = n . M = 0,6 . 158 = 94,8 (g)
b. 2\(KClO_3\) ---> 2\(KCl\) + 3\(O_2\) (Lập và cân bằng phương trình)
0,2 mol 0,2 mol 0,3 mol
Số g \(KClO_3\) dùng để điều chế:
\(m_{KClO_3}\) = n . M = 0,2 . 122,5 = 24,5 (g)
c. 2Cu + \(O_2\) ---> 2\(CuO\) (Lập và cân bằng phương trình)
0,6 mol 0,3 mol 0,6 mol
Số g của CuO sau phản ứng thu được:
\(m_{CuO}\) = n . M = 0,6 . 80 = 48 (g)
________________________________________
Bài 4 trước nha bạn, có gì sai thì nhắn mình :))
Bài 5. CuO + \(H_2\) ---> Cu + \(H_2O\) (Lập và cân bằng phương trình)
0,2 mol 0,2 mol 0,2 mol 0,2 mol
a. + Số mol của CuO:
\(n_{CuO}\) = \(\dfrac{m}{M}\) = \(\dfrac{16}{80}\) = 0,2 (mol)
+ Thể tích của \(H_2\)
\(V_{H_2}\) = n . 22,4 = 0,2 . 22,4 = 4,48 (lít)
b. Khối lượng Cu sau phản ứng:
\(m_{Cu}\) = n . M = 0,2 . 64 = 12,8 (g)
______________________________
Bài 5 nha, sai thì nhắn mình :))
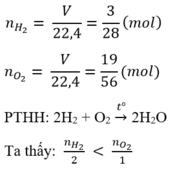
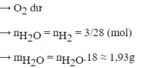
PTHH: 2\(H_2\) + \(O_2\) ---> 2\(H_2O\) (Lập và cân bằng phương trình)
1 mol 0,5 mol 1 mol
+ Số mol của \(H_2\)
\(n_{H_2}\) = \(\dfrac{m}{M}\) = \(\dfrac{2}{2}\) = 1 (mol)
+ Thể tích của \(O_2\)
\(V_{O_2}\) = n . 22,4 = 0,5 . 22,4 = 11,2 (lít)
Ta có: nH2=2/2=1(mol)
Phương trình hóa học: 2H2 + O2 ---to---> 2H2O.
Theo PT, ta có: nO2=1/2 . nH2=1/2 . 1=0,5(mol)
=> VO2=0,5.22,4=11,2(lít)