Câu 10. Hòa tan hết 4,87gam hỗn hợp (A) gồm Al và Zn bằng lượng vừa đủ 360ml dung dịch HNO3 1M thì thoát ra 1,12lít (đktc) hỗn hợp khí (B) gồm NO và N2O. Biết tỉ khối hơi của hỗn hợp (B) so với H2 là 16,4. Tìm số mol mỗi kim loại trong hỗn hợp A
Câu 11. Hấp thụ hoàn toàn 4,48 lít khí CO2 (ở đktc) vào 500 ml dung dịch hỗn hợp gồm NaOH 0,1M và Ba(OH)2 0,2M, sau phản ứng thu được m gam kết tủa và dung dịch X.
a) Tính giá trị m.
b) Tính tổng khối lượng các chất tan có trong dung dịch X.

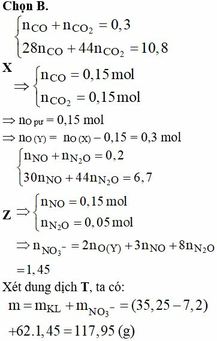
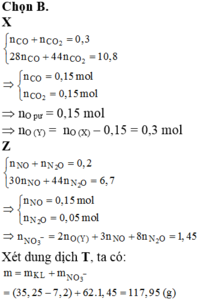
Gọi số mol của NO và N2O là a, b
=> \(\left\{{}\begin{matrix}a+b=\dfrac{1,12}{22,4}=0,05\\\dfrac{30a+44b}{a+b}=16,4.2=32,8\end{matrix}\right.=>\left\{{}\begin{matrix}a=0,04\\b=0,01\end{matrix}\right.\)
Gọi số mol của Al, Zn là x, y
=> 27x + 65y = 4,87
nHNO3 = 0,36.1 = 0,36 (mol)
Al0-3e--> Al+3
x-->3x
Zn0-2e-->Zn+2
y-->2y
4H+ + NO3- +3e--> NO + 2H2O
0,16<------0,12<-0,04
10H+ + 2NO3- +8e--> N2O + 5H2O
0,1<------------0,08<--0,01
10H+ + 2NO3- +8e--> NH4NO3 + 3H2O
0,1------------->0,08
Bảo toàn e: 3x + 2y = 0,28
=> a = 0,06; b = 0,05
a) \(n_{CO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
\(n_{NaOH}=0,5.0,1=0,05\left(mol\right)\)
\(n_{Ba\left(OH\right)_2}=0,5.0,2=0,1\left(mol\right)\)
PTHH: Ba(OH)2 + CO2 --> BaCO3 + H2O
_______0,1------>0,1------>0,1
2NaOH + CO2 --> Na2CO3 + H2O
_0,05-->0,025----->0,025
Na2CO3 + CO2 + H2O --> 2NaHCO3
0,025--->0,025------------->0,05
BaCO3 + CO2 + H2O --> Ba(HCO3)2
0,05<---0,05--------------->0,05
=> mBaCO3 = (0,1-0,05).197 = 9,85(g)
b)
mNaHCO3 = 0,05.84 = 4,2 (g)
mBa(HCO3)2 = 0,05.259 = 12,95(g)
=> Tổng khối lượng chất tan = 4,2 + 12,95 = 17,15 (g)