cho m gam bột fe vào 250ml dung dịch agno3 0,12M. Sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch X và 3,333 gam chất rắn. Giá trị của m là?
cho đáp án thôi ạ khỏi trình bày
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
GIẢ SỬ Ag+ bị “đẩy” ra hết ![]()
=> chất rắn sau phản ứng chứa Fe dư. Đặt n F e phản ứng = x, n A l = y
4Fe dư => X chứa ![]()
![]()
Bảo toàn khối lượng gốc kim loại: 0,42 + 0,03 x 108 = 56x + 27y = 3,333
=> Giải hệ có: x = 0,0015 mol; y = 0,009 mol; ![]()
=> Chọn C

Đáp án C
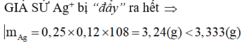
=> chất rắn sau phản ứng chứa Fe dư. Đặt
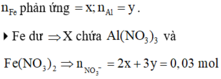
Bảo toàn khối lượng gốc kim loại:
![]()
=> giải hệ có: x = 0,0015 mol; y = 0,009 mol
![]()

Đáp án C
Ta có: ![]()
Ta có: ![]()
Bảo toàn điện tích:

Do vậy rắn Z chứa 0,038 mol Mg dư.
BTKL:
Do vậy rắn Z chứa 0,038 mol Mg dư.
BTKL: ![]()
![]()

Đáp án D
nAgNO3 = 0,036 mol
nCu(NO3)2 = 0,024 mol
Xét cả quá trình phản ứng, ta thấy chỉ có Mg nhường e và Ag+, Cu2+ nhận e.
Bte: 2nMg pư = nAg+ + 2nCu2+ => nMg pư = (0,036 + 2.0,024):2 = 0,042 mol
=> nMg dư = 0,08 – 0,042 = 0,038 mol
Ta có: mX + mY = m + mAg + mCu + mMg dư => 4,21 + 4,826 = m + 0,036.108 + 0,024.64 + 0,038.24
=> m = 2,7 gam

Đáp án C
Ta có: ![]()
Ta có: ![]()
Bảo toàn điện tích:
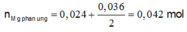
Do vậy rắn Z chứa 0,038 mol Mg dư.
BTKL: m = 4,826 - 0,038.24 + 4,21 - 0,036.108 - 0,024.64 = 2,7 gam
nAgNO3 = 0,12.0,25 = 0,03(mol)
PTHH: Fe + 2AgNO3 --> Fe(NO3)2 + 2Ag
_____0,015<-0,03-------------------->0,03
=> 56(x-0,015) + 0,03.108 = 3,3333
=> x = 0,01666 (mol)
=> m = 0,01666.56 = 0,93296(g)
\(Fe + 2AgNO_3 \rightarrow Fe(NO_3)_2 + 2Ag\)
Ta có:
\(n_{AgNO_3}= 0,12 . 0,25=0,03 mol\)
Theo PTHH:
\(n_{Ag}=n_{AgNO_3}= 0,03 mol\)
\(\Rightarrow m_{Ag}= 0,03 . 108= 3,24 g < 3,333g\)\(\Rightarrow m_{Fe dư}= 3,333 - 3,24 =0,093 g\)
\(n_{Fe pư}= \dfrac{1}{2} n_{AgNO_3}= 0,015 mol\)
\(\Rightarrow m= m_{Fe dư} + m_{Fe pư}= 0,015 . 56 + 0,093=0,933 g\)