Cho 20g hỗn hợp kim loại gồm Kẽm và Đồng tác dụng hoàn toàn với 200ml dung dịch FeSO4 1M. Khối lượng của kẽm và đồng trong hỗn hợp kim loại ban đầu là:
A. 12,8g và 7,2g.
B. 13g và 7g.
C. 6,5g và 13,5g
D. 6,4g và 13,6g
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{CuSO_4}=0,2.1=0,2(mol)\\ PTHH:Mg+CuSO_4\to MgSO_4+Cu\\ \Rightarrow n_{Mg}=0,2(mol)\\ \Rightarrow m_{Mg}=0,2.24=4,8(g)\\ \Rightarrow m_{Ag}=m_{hh}-m_{Mg}=20-4,8=15,2(g)\)

\(n_{HCl}=1.0,2=0,2(mol)\\ PTHH:Mg+2HCl\to MgCl_2+H_2\\ \Rightarrow n_{Mg}=\dfrac{1}{2}n_{HCl}=0,1(mol)\\ \Rightarrow m_{Mg}=0,1.24=2,4(g)\\ \Rightarrow m_{Cu}=10-2,4=7,6(g)\)

a)
$Zn + H_2SO_4 \to ZnSO_4 + H_2$
Theo PTHH : $n_{Zn} = n_{H_2} = \dfrac{2,8}{22,4} = 0,125(mol)$
$m_{Zn} = 0,125.65 = 8,125(gam)$
$m_{Cu} = 8,3 - 8,125 = 0,175(gam)$
$\%m_{Zn} = \dfrac{8,125}{8,3}.100\% = 97,9\%$
$\%m_{Cu} = 100\% -97,9\% = 2,1\%$
$n_{H_2SO_4} = n_{H_2} = 0,125(mol) \Rightarrow m_{H_2SO_4} = 0,125.98 = 12,25(gam)$

a,\(n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PTHH: Zn + 2HCl → ZnCl2 + H2
Mol: x x
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: y y
Ta có: \(\left\{{}\begin{matrix}65x+56y=30,7\\x+y=0,5\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,3\left(mol\right)\\y=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\%m_{Zn}=\dfrac{0,3.65.100\%}{30,7}=63,52\%;\%m_{Fe}=100\%-63,52\%=36,48\%\)
b,
PTHH: Zn + 2HCl → ZnCl2 + H2
Mol: 0,3 0,6
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: 0,2 0,4
nHCl = 0,6+0,4 = 1 (mol)
\(V_{ddHCl}=\dfrac{1}{2}=0,5\left(l\right)=500\left(ml\right)\)

\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
1 1 1 1 (mol)
0,00005 0,00005
\(Cu+H_2SO_4\) ( không có pứ xảy ra ) .
VH2 = 1,12 ml = 0,00112(l)
\(nH_2=\dfrac{0,00112}{22,4}=0,00005\left(mol\right)\)
\(\Rightarrow mZn=0,00005.65=0,00325\left(g\right)\)
\(\Rightarrow mCu=12,85-0,00325=12,84675\left(g\right)\)

n C u S O 4 = 0,525.0,2 = 0,105 m o l
Vì thu được kết tủa là 2 kim loại nên Fe còn dư.
Suy ra, kết tủa là Fe dư và C u , C u S O 4 phản ứng hết.
Gọi a, b, c là số mol của Al phản ứng, Fe phản ứng và Fe dư.
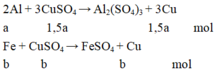
Từ phương trình phản ứng và dữ kiện đề bài cho, ta lập được hệ phương trình:
3 2 a + b = n C u S O 4 a .27 + b .56 + c .56 = m K L 3 2 a .64 + b .64 + c .56 = m k e t t u a ⇔ 3 2 a + b = 0,105 27 a + 56 b + 56 c = 4,15 96 a + 64 b + 56 c = 7,84
⇔ a = 0,05 b = 0,03 c = 0,02
Vậy n A l = 0 , 05 m o l ; n F e b đ = b + c = 0 , 05 m o l .
Đáp án C

a/ PTHH: Mg + 2HCl ===> MgCl2 + H2
x 2x x x
Fe + 2HCl ===> FeCl2 + H2
y 2y y y
Gọi số mol Mg, Fe lần lượt là x, y
Lập các số mol theo phương trình
nH2 = 8,96 / 22,4 = 0,4 mol
Theo đề ra, ta có hệ phương trình:
\(\begin{cases}24x+56y=12,8\\x+y=0,4\end{cases}\)=>\(\begin{cases}x=0,3\\y=0,1\end{cases}\)
=> mMg = 0,3 x 24 = 7,2 gam
mFe = 0,1 x 56 = 5,6 gam
b/ \(\sum nHCl\) = 0,8 mol
=> VHCl = 0,8 / 2 = 0,4 lít = 400ml
c/ PTHH: MgCl2 + 2NaOH ===> Mg(OH)2 + 2NaCl
0,3 0,6 0,3
FeCl2 + 2NaOH ===> Fe(OH)2 + 2NaCl
0,1 0,2 0,1
=> \(\sum m\downarrow\) = 0,3 x ( 24 + 16 x 2 + 2) + 0,1 x ( 56 + 16 x 2 + 2) = 26,4 gam

\(a.Fe+2HCl\rightarrow FeCl_2+H_2\\ Mg+2HCl\rightarrow MgCl_2+H_2\\ b.Chấtrắnkhôngtan:Cu\\ \%m_{Cu}=54,24\%\\ Đặt:\left\{{}\begin{matrix}n_{Fe}=x\left(mol\right)\\n_{Mg}=y\left(mol\right)\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}2x+2y=\dfrac{91,25.20\%}{36,5}\\56x+24y=23,6-12,8\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}x=0,15\\y=0,1\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=35,59\%\\\%m_{Mg}=10,17\%\end{matrix}\right.\)

V = 0,1 : 0,5 = 0,2 (l)
a -> 3/2a
Fe + H2SO4 -> FeSO4 + H2
a -> a
\(n_{Zn}=n_{FeSO_4}=0.2\left(mol\right)\)
\(\Rightarrow m_{Zn}=0.2\cdot65=13\left(g\right)\)
\(m_{Cu}=20-13=7\left(g\right)\)
\(B\)