Câu 1: Cho m (gam) bột Zn tác dụng với dung dịch HNO3 có dư thu được muối Zn(NO3)2 và hỗn hợp khí gồm 6,72 lít NO2 và 2,24 lít NO. Tính giá trị m (biết các khí đo ở đkc)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a,\(n_{Zn}=\dfrac{26}{65}=0,4\left(mol\right)\);\(n_{hhNO;NO_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
PTHH: 3Zn + 8HNO3 → 3Zn(NO3)2 + 2NO + 4H2O
Mol: x 2/3x
PTHH: Zn + 4HNO3 → Zn(NO3)2 + 2NO2 + 2H2O
Mol: y 2y
Ta có: \(\left\{{}\begin{matrix}x+y=0,4\\\dfrac{2}{3}x+2y=0,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,3\\y=0,1\end{matrix}\right.\)
PTHH: 3Zn + 8HNO3 → 3Zn(NO3)2 + 2NO + 4H2O
Mol: 0,3 0,8 0,3 0,2
PTHH: Zn + 4HNO3 → Zn(NO3)2 + 2NO2 + 2H2O
Mol: 0,1 0,4 0,1 0,2
\(m_{HNO_3}=\left(0,8+0,4\right).63=75,6\left(g\right)\)
\(\Rightarrow m_{ddHNO_3}=\dfrac{75,6.100}{10}=756\left(g\right)\)
b,mdd sau pứ = 26+756-0,2.30-0,2.46 = 766,8 (g)
\(C\%_{ddZn\left(NO_3\right)_2}=\dfrac{\left(0,3+0,1\right).189.100\%}{766,8}=9,86\%\)

Chọn B.
![]() Þ M không tác dụng được với NaOH.
Þ M không tác dụng được với NaOH.
Từ đó suy ra: ![]()
![]() (với n là hoá trị của M)
(với n là hoá trị của M)
Mà ![]() Từ (1), (2) suy ra M = 56 (Fe)
Từ (1), (2) suy ra M = 56 (Fe)
Vậy tính chất của M là không tan được trong dung dịch H2SO4 đặc, nguội.

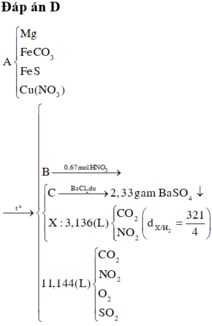
Đáp án : D
Xét X : có nX = 0,14 mol ; MX = 321/7g
Áp dụng qui tắc đường chéo => nCO2 = 0,01 mol ; nNO2 = 0,13 mol
Kết tủa 2,33g chính là BaSO4 => nBaSO4 = nSO2 = 0,01 mol
Khi khí B + HNO3 :
4NO2 + O2 + 2H2O -> 4HNO3
,x -> 0,25x
=> nB = nSO2 + nCO2 + nNO2 + nO2
=> 0,495 = 0,01 + 0,01 + 0,13 + x + 0,25x
=> x = 0,276 mol
Bảo toàn nguyên tố :
,nFeCO3 = nCO2 = 0,01 ; nCu(NO3)2 = ½nNO2 = 0,203 mol
=> nO(X) = 3nFeCO3 + 6nCu(NO3)2 = 1,248 mol
Vì %mO = 47,818% => m = 41,76g


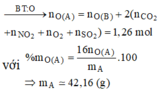





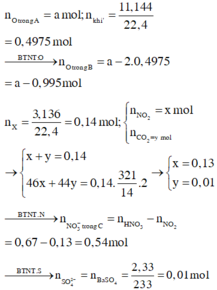

Gọi số mol Zn là a (mol)
\(n_{NO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\); \(n_{NO}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(Zn^0-2e\rightarrow Zn^{+2}\)
a----->2a________________(mol)
\(N^{+5}+1e\rightarrow N^{+4}\)
_____0,3<---0,3___________(mol)
\(N^{+5}+3e\rightarrow N^{+2}\)
_____0,3<---0,1___________(mol)
THEO ĐLBT e: 2a = 0,6
=> a = 0,3 (Mol)
=> m = 0,3.65 = 19,5(g)