Hòa tan 2,8g Fe bằng dung dịch HCl 2M vừa đủ, Tính thể tích dd HCl cần dùng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(2Al + 6HCl \rightarrow 2AlCl_3 + 3H_2\)
\(n_{Al}= \dfrac{5,4}{27}= 0,2 mol\)
Theo PTHH:
\(n_{AlCl_3}= n_{Al}= 0,2 mol\)
\(\Rightarrow m_{AlCl_3}= 0,2 . 133,5=26,7 g\)
Theo PTHH:
\(n_{H_2}= \dfrac{3}{2} n_{Al}= 0,3 mol\)
\(\Rightarrow V= 0,3 . 22,4= 6,72 l\)
b)
Theo PTHH:
\(n_{HCl}= 3n_{Al}= 0,6 mol\)
\(\Rightarrow m_{HCl}= 0,6 . 36,5=21,9 g\)
\(\Rightarrow m_{dd HCl}= \dfrac{21,9 . 100}{15}= 146 g\) ( nếu ở tử là : 21,9 . 100% thì ở mẫu bạn chia cho 15% nhé)

a) \(n_{Al}=\dfrac{m}{M}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
\(PTHH:2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
Số mol : 2mol.........6mol
Sau p/ư : 0,2mol........ x
\(n_{HCl}=x=\dfrac{0,2.6}{2}=0,6\left(mol\right)\)
Ta có : \(n_{HCl}=\dfrac{16\%.m_{HCl}}{100\%.36,5}\)
\(\Rightarrow0,6=\dfrac{16.m_{HCl}}{100.36,5}\)
\(\Rightarrow m_{HCl}=\dfrac{2190}{16}=136,875\left(g\right)\)
b) \(n_{AlCl_3}=\dfrac{3}{2}n_{Al}=0,3\left(mol\right)\)
\(m_{AlCl_3}=0,3.133,5=40,05\left(g\right)\)
\(\Rightarrow C_{\%ddAlCl_3}=\dfrac{40,05}{5,4+136,875}.100\approx27,95\%\)
Bạn đúng rồi mình nhìn nhầm sang H2, xin lỗi nhé !
Sửa : \(n_{AlCl_3}=n_{Al}=0,2\left(mol\right)\)
Phần dưới tự làm tiếp nhé ![]()
minh nguyet

\(n_{MgCO_3}=\dfrac{21}{84}=0,25\left(mol\right)\\ a.MgCO_3+2HCl\rightarrow MgCl_2+CO_2+H_2O\\ n_{HCl}=0,25.2=0,5\left(mol\right)\\ b.V_{ddHCl}=\dfrac{0,5}{2}=0,25\left(l\right)=250\left(ml\right)\)

\(n_{H_2}=\dfrac{2,24}{22,4}=0,1(mol)\\ Mg+2HCl\to MgCl_2+H_2\\ MgO+2HCl\to MgCl_2+H_2O\\ \Rightarrow n_{Mg}=0,1(mol)\\ \Rightarrow \%_{Mg}=\dfrac{0,1.24}{6,4}.100\%=37,5\%\\ \Rightarrow \%_{MgO}=100\%-37,5\%=62,5\%\)
\(b,n_{MgO}=\dfrac{6,4-0,1.24}{40}=0,1(mol)\\ \Rightarrow n_{HCl}=2.0,1+2.0,1=0,4(mol)\\ \Rightarrow V_{dd_{HCl}}=\dfrac{0,4}{0,5}=0,8(l)\\ c,n_{MgCl_2}=0,1+0,1=0,2(mol)\\ \Rightarrow C_{M_{MgCl_2}}=\dfrac{0,2}{0,8}=0,25M\)

a. \(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
0,25 ..... 0,5 ................... 0,25 (mol)
\(m_{Mg}=0,25.24=6\left(g\right)\)
\(\rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{6}{10}.100\%=60\%\\\%m_{MgO}=100\%-60\%=40\%\end{matrix}\right.\)
\(MgO+2HCl\rightarrow MgCl_2+H_2O\)
0,1 ....... 0,2 (mol)
\(n_{HCl}=0,25+0,1=0,35\left(mol\right)\)
\(C_M\left(HCl\right)=\dfrac{0,35}{0,1}=3,5\left(M\right)\)
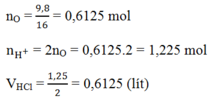
nFe = \(\dfrac{mFe}{MFe}\)=\(\dfrac{2,8}{56}=0,05mol\)
Fe+ 2HCl -> FeCl2 + H2
1 2 1 1
0,05->0,1->0,05->0,05
VddHCl = \(\dfrac{nHCl}{C_MHCl}\)=\(\dfrac{0,1}{2}=0,05l\)