Vd:
Tính thể tích khí ở đkc của 0,175 mol CO\(_2\).
1,2395 lít khí A ở điều kiện chuẩn có số mol là bao nhiêu?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) + nNa = 11,5/23 = 0,5 (mol)
+ nO2 = 1,2/24 = 0,05 (mol)
b) + mMg = 0,6.24 = 14,4 (g)
+ nCO2 = \(\frac{1,8.10^{21}}{6.10^{23}}=0,003\left(mol\right)\)
c) VCO2 = 0,175.22,4 = 3,92 (l)
VH2 = 0,2.22,4 = 4,48 (l)
A) nNa= \(\frac{m_{Na}}{M_{Na}}=\frac{11,5}{23}=0,5\left(mol\right)\)
\(n_{O_2}=\frac{V_{O_2}}{24}=\frac{1,2}{24}=0,05\left(mol\right)\)

\(a.V_{NH_3}=0,8.22,4=17,92\left(l\right)\\ b.n_{N_2}=\dfrac{140}{28}=5\left(mol\right)\\ V_{N_2}=112\left(l\right)\\ n_{O_2}=\dfrac{96}{32}=3\left(mol\right)\\ V_{O_2}=22,4.3=67,2\left(l\right)\)
\(c.n_{hh}=0,5+0,2=0,7\left(mol\right)\\ V_{hh}=0,7.22,4=15,68\left(l\right)\\ d.m_{NH_3}=4,25\left(g\right)\\ n_{CO}=\dfrac{28}{22,4}=1,25\left(mol\right)\\ m_{CO}=1,25.28=35\left(g\right)\\ m_{hh}=4,25+35=39,25\left(g\right)\)
a. Thể tích của 0,8 mol khí NH3 (đktc)
=>VNH3=0,8.22,4=17,92l
b. Thể tích ở đktc của 140 g khí Nitơ ; 96g khí Oxi
nN2=140\14.2=5 mol
nO2=96\32=3 mol
=>Vhh=(5+3).22,4=179,2l
c. Thể tích của hỗn hợp khí gồm 0,5 mol Cl2 và 0,2 mol N2 ở điều kiện tiêu chuẩn.
=>Vhh=(0,5+0,2).22,4=15,68l
d. Khối lượng của hỗn hợp 0,25 mol khí NH3 , 28lit khí CO.
n CO=28\22,4=1,25 mol
=>mhh=0,25.17+1,25.28=39,25g

a, Hiện tượng: tạo ra kết tủa màu trắng
\(n_{CO_2}=\dfrac{2,479}{24,79}=0,1\left(mol\right)\)
PTHH: CO2 + Ba(OH)2 → BaCO3 + H2O (Ba(OH)2 là dd X )
Mol: 0,1 0,1 0,1
b, \(m_{BaCO_3}=0,1.197=19,7\left(g\right)\)
c, \(m_{HCl}=50.7,3\%=3,65\left(g\right)\Rightarrow n_{HCl}=\dfrac{3,65}{36,5}=0,1\left(mol\right)\)
PTHH: Ba(OH)2 + 2HCl → BaCl2 + 2H2O
Mol: 0,05 0,1
\(n_{Ba\left(OH\right)_2banđầu}=0,05+0,1=0,15\left(mol\right)\)
\(\Rightarrow C_{M_{ddBa\left(OH\right)_2}}=\dfrac{0,15}{0,2}=0,75M\)

\(n_{Al}=\dfrac{m}{M}=\dfrac{0,54}{27}=0,02mol\)
\(n_{H_2SO_4}=\dfrac{m}{M}=\dfrac{22,05}{98}=0,225mol\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,02 < 0,225 ( mol )
0,02 0,03 ( mol )
\(V_{H_2}=n.22,4=0,03.24,79=0,7437l\)

Gọi n là số mol khí cacbonic chứa trong bình: n = m/ μ , trong đó M là khối lượng khí cacbonic có trong bình, μ là khối lượng mol của khí cacbonic.
Ta có n = 100 mol
Nếu gọi V 0 là thể tích của lượng khí cacbonic ở điều kiện chuẩn ( p 0 = 1,013. 10 5 Pa; T 0 = 273 K) thì V 0 = n v 0
Áp dụng phương trình trạng thái của khí lí tưởng cho lượng khí cacbonic:
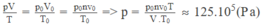

Điều kiện tiêu chuẩn : nhiệt độ 0oC , áp suất 1 atm.
Thể tích mol phân tử của chất khí là thể tích chứa 6,022.1023 phân tử khí hay 1 mol chất khí.
Ở đktc , thể tích của 1 mol chất khí bằng 22,4 lít.
Người ta quy ước điều kiện thường là ở nht độ 20oC và áp suất 1 atm.
Điều kiện tiêu chuẩn : nhiệt độ 0oC , áp suất 1 atm
Thể tích mol phân tử của chất khí là thể tích chứa 6.1023 phân tử khí hay 1 mol chất khí. -
Ở đktc , thể tích của 1 mol chất khí bằng 22,4 lít.
- Người ta quy ước điều kiện thường là ở nht độ 20oC và áp suất 1 atm.

\(k_1=\dfrac{V_1}{n_1}=\dfrac{4,958}{0,2}=24,790\\ k_2=\dfrac{V_2}{n_2}=\dfrac{12,395}{0,5}=24,790\\ k_3=\dfrac{V_3}{n_3}=\dfrac{24,790}{1}=24,790\\ k_4=\dfrac{V_4}{n_4}=\dfrac{49,580}{2}=24,790\\ Vậy:k_1=k_2=k_3=k_4=24,79\\ \Rightarrow n=\dfrac{V_{\left(đkc\right)}}{24,79}\)

\(a,n_{CO_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
\(n_{CO_2}=0,5.44=11\left(g\right)\)
\(b,n_{NH_3}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
\(n_{NH_3}=0,45,17=7,65\left(g\right)\)
\(c,n_{NO_2}=\dfrac{16,8}{22,4}=0,75\left(mol\right)\)
\(n_{NO_2}=0,75.46=34,5\left(g\right)\)
Sử dụng được công thức để chuyển đổi giữa số mol và thể tích chất khí ở điều kiện chuẩn: áp suất 1 bar ở 25 0C. \(n=\dfrac{V}{24,79}\left(mol\right)\)
\(V_{CO_2}=0,175.24,79=4,33825\left(l\right)\)
\(n_A=\dfrac{1,2395}{24,79}=0,05\left(mol\right)\)