Cho luồng khí CO dư đi qua 36,4g hỗn hợp Al2O3 và Fe2O3 nung nóng sau phản ứng để nguội cân lại thấy khối lượng hỗn hợp còn lại 86,813% so với ban đầu (phản ứng xảy ra hoàn toàn)
a) Phương trình phản ứng và tính khối lượng kim loại thu được
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phương trình hóa học:
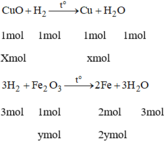
Gọi x là số mol của CuO
y là số mol của F e 2 O 3 .
Ta có: 80x + 160y = 16 (1)
Khối lượng hỗn hợp giảm do oxit tạo thành kim loại:
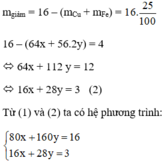
Giải hệ phương trình ta được:
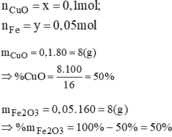

Đáp án B
Khí CO khử được oxit kim loại sau nhôm
CO + CuO → Cu + CO2
3CO + Fe2O3 → 2Fe + 3CO2
Vậy hỗn hợp rắn còn lại trong ống sứ gồm Al2O3, Cu, Fe, MgO

CO khử được oxit của các kim loại đứng sau Al tạo thành kim loại tương ứng và giải phóng khí CO2.
Đáp án B

$m_{O\ trong\ oxit} = m_{giảm} = 20.24\%= 4,8(gam)$
$\Rightarrow n_O = \dfrac{4,8}{16} = 0,3(mol)$
Gọi $n_{Fe_2O_3} = a(mol) ; n_{CuO} = b(mol) \Rightarrow 160a + 80b = 20(1)$
Ta có : $n_O = 3a + b = 0,3(2)$
Từ (1)(2) suy ra : a = 0,05 ; b = 0,15
$\%m_{CuO} = \dfrac{0,15.80}{20}.100\% = 60\%$

Đáp án D
Gọi nCuO = x ; nFe2O3 = y
=> Sau phản ứng : nCu = x ; nFe = 2y
=> mhh đầu = 80x + 160y = 2,4 và mhh sau = 64x + 112y = 1,76
=> x = y = 0,01 mol
=> %mCuO(hh đầu) = 33,33%
=>D
\(Fe_2O_3 + 3CO \xrightarrow{t^o} 2Fe + 3CO_2\)
Gọi \(n_{Fe_2O_3\ pư} = a(mol)\)
Theo PTHH : \(n_{Fe} = 2n_{Fe_2O_3} = 2a(mol)\)
Ta có :
\(m_{hỗn\ hợp} = m_{Al_2O_3} + 160a(gam)\)
\(m_{rắn\ sau\ phản\ ứng} = m_{Al_2O_3} + m_{Fe} = m_{Al_2O_3} + 112a(gam)\)
Ta có :
\(m_{giảm} = 160a - 112a = 36,4(100\% - 86,813\%)\)
Suy ra : a = 0,1
Vậy : \(m_{Fe} = 0,1.2.56 = 11,2(gam)\)
Al2O3+3CO→2Al+3CO2
Fe2O3+3CO→2Fe+3CO2
m kim loại=36,4x86,813%=31,6 g