Cho 2,16 gam kim loại M hóa trị 3 tác dụng với dung dịch HNO3 loãng, dư thu được 0,027 mol hỗn hợp khí N2O và N2 có tỉ khối so với Hiđro là 18,45. Xác định kim loại M.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


1.
RCO3 -> RO + CO2
Áp dụng ĐLBTKL ta có:
mRCO3=mRO+mCO2
=>mCO2=10-5,6=4,4((g)\(\Leftrightarrow\)0,1(mol)
VCO2=22,4.0,1=2,24(lít)
Theo PTHH ta có:
nRCO3=nCO2=0,1(mol)
MRCO3=\(\dfrac{10}{0,1}=100\)
=>MR=100-60=40
=>R là Ca
4.
R + H2SO4 -> RSO4 + H2
nH2=0,5(mol)
Theo PTHH ta có:
nR=nH2=0,5(mol)
MR=\(\dfrac{12}{0,5}=24\)
=>R là Mg

Gọi 2 kim loại lần lượt là A và B
Gọi \(n_B=a\left(mol\right)\rightarrow n_A=3a\left(mol\right)\)
PTHH:
A + H2SO4 ---> ASO4 + H2
3a 3a
2B + 3H2SO4 ---> B2(SO4)3 + 3H2
a 1,5a
=> 3a + 1,5a = 0,45
=> a = 0,1 (mol)
Ta có: \(M_A.0,1.3+M_B.0,1=0,3M_A+0,1M_B=5,4\left(g\right)\)
Mà \(M_B=3M_A\)
\(\rightarrow0,3M_A+0,3M_A=5,4\left(g\right)\\ \rightarrow M_A=9\left(\dfrac{g}{mol}\right)\)
=> MB = 9.3 = 27 (g/mol)
=> A và B lần lượt là Beri và Nhôm

\(n_{H_2}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\) \(n_{H_2SO_4}=0,3.0,25=0,075\left(mol\right)\)
\(X+H_2SO_{4\left(l\right)}\rightarrow XSO_4+H_2\uparrow\)
0,06 0,06 0,06 0,06 (mol)
dư:0 0,015 0 0 (mol)
b/
m\(M_X=\dfrac{3,36}{0,06}=56\left(g\right)\)
\(\rightarrow Fe\)
c/
\(2Fe+6H_2SO_{4\left(đn\right)}\rightarrow Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
0,06 0,09 (mol)
V\(_{SO_2}=0,09.22,4=2,016\left(l\right)\)

Đáp án B
Phương trình phản ứng
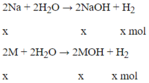
Theo đề bài ta có: 23x +Mx = 6,2 (1)
Áp dụng định luật bảo toàn khối lượng ta có:
mkim loại + mnước = mdd + mhiđro
Từ đó: mhiđro = mkim loại - mnước = mdd = 6,2 + 104 - 110 = 0,2 (g)
⇒x = 0,1 mol, thay vào (1) ta được M = 39 (K)

\(n_{H_2}=\dfrac{13,44}{22,4}=0,6mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,6 1,2 0,6 0,6 ( mol )
\(m_{Fe}=0,6.56=33,6g\)
\(m_{FeCl_2}=0,6.127=76,2g\)
\(C_{M_{HCl}}=\dfrac{1,2}{0,6}=2M\)

`Fe + 2HCl -> FeCl_2 + H_2↑`
`0,3` `0,6` `0,3` `0,3` `(mol)`
`n_[H_2] = [ 6,72 ] / [ 22,4 ] = 0,3 (mol)`
`-> m_[Fe] = 0,3 . 56 = 16,8 (g)`
`-> m_[FeCl_2] = 0,3 . 127 = 38,1 (g)`
`b) C_[M_[HCl]] = [ 0,6 ] / [ 0,3 ] = 2 (M)`
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: Fe + 2HCl ---> FeCl2 + H2
0,3<---0,6<------0,3<-----0,3
=> \(\left\{{}\begin{matrix}m_{Fe}=0,3.56=16,8\left(g\right)\\m_{FeCl_2}=127.0,3=38,1\left(g\right)\\C_{M\left(HCl\right)}=\dfrac{0,6}{0,3}=2M\end{matrix}\right.\)
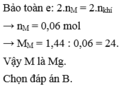
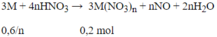
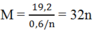
Gọi \(n_{N_2O} = a ; n_{N_2} = b(mol)\)
Ta có :
\(n_{khí} = a + b = 0,027(mol)\\ m_{khí} = 44a + 28b = M.n = 18,45.2.0,027 = 0,9963(gam)\)
Suy ra a = 0,015 ; b = 0,012
Bảo toàn electron :
\(3n_M = 8n_{N_2O} + 10n_{N_2} = 0,015.8 + 0,012.10 = 0,24\\ \Rightarrow n_M = 0,08(mol)\\ \Rightarrow M = \dfrac{2,16}{0,08} = 27(Al)\)
Vậy kim loại M là Al