Hòa tan hoàn toàn 1,98 gam hỗn hợp gồm Cu và Al2O3 vào V lít dung dịch HNO3 1M. Sau phản ứng thu được 0,224 lít NO (đo ở đktc, sản phẩm khử duy nhất) và dung dịch X.
a. Tính thành phần phần trăm theo khối lượng mỗi chất trong hỗn hợp đầu?
b. Thêm từ từ dung dịch Y gồm NaOH 1M và Ba(OH)2 0,5M vào X đến khi lượng kết tủa không đổi nữa thì thấy dùng hết 100 ml Y. Tính V?



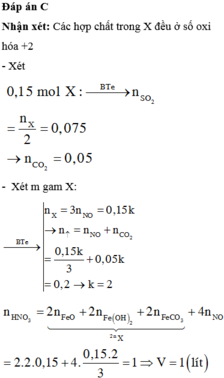
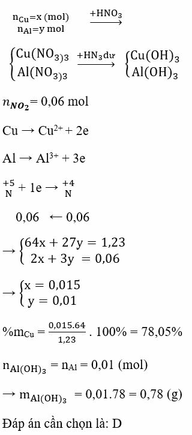
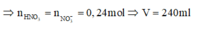
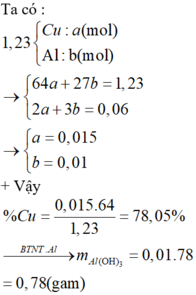
a)
\(n_{NO} = 0,01(mol)\)
Bảo toàn electron : \(2n_{Cu} = 3n_{NO}\)
\(\Rightarrow n_{Cu} = 0,015(mol)\)
Vậy :
\(\%m_{Cu} = \dfrac{0,01.64}{1,98}.100\% = 32,32\%\\ \%m_{Al_2O_3} = 100\% - 32,32\% = 67,68\%\)
b)
\(n_{Al_2O_3} = \dfrac{1,98-0,015.64}{102} = 0,01(mol)\)
\(n_{OH^-} = n_{NaOH} + 2n_{Ba(OH)_2} = 0,1.1 + 0,5.0,1.2 = 0,2(mol)\)
Ta có :
\(n_{Cu(NO_3)_2} = n_{Cu} = 0,015(mol)\\ n_{Al(NO_3)_3} = 2n_{Al_2O_3} = 0,02(mol)\)
Mà : \(n_{OH^-} = 4n_{Al(NO_3)_3} + 2n_{Cu(NO_3)_2} + n_{HNO_3\ dư}\)
\(\Rightarrow n_{HNO_3\ dư} = 0,09(mol)\)
Bảo toàn nguyên tố với N :
\(n_{HNO_3\ pư} = 3n_{Al(NO_3)_3} + 2n_{Cu(NO_3)_2} = 0,06(mol)\)
Vậy, \(V = \dfrac{0,09 + 0,06}{1} = 0,15(lít)\)