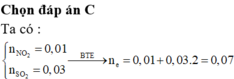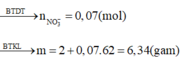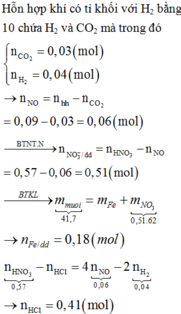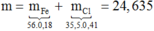Hòa tan hoàn toàn 3,6 gam kim loại R (hóa trị II) bằng 197,5 ml dung dịch HNO3 2M, thu được dung dịch A và hỗn hợp khí gồm NO, N2O có tỷ khối so với H2 là 19,2. Chia dung dịch A thành 2 phần bằng nhau: a/ Đem cô cạn thu được chất rắn E. Nung chất rắn E đến khối lượng không đổi thu được 3 gam chất rắn. Xác định kim loại R. b/ Thêm 1,10625 lít dung dịch H2SO4 0,2M vào phần II, nếu cho lượng dư bột Al vào tiếp thì thu được tối đa bao nhiêu lít khí. Biết N+5 bị khử thành N0. ( Thể tích các khí đo ở điều kiện tiêu chuẩn).
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

mdd HNO3=592,2g
--> nHNO3=0,94 mol
Gọi x,y lần lượt là số mol từng khí
x+y=0,12
44x+30yx+y=18,5.244x+30yx+y=18,5.2
x=y=0,06 mol
Bảo toàn e
5,94R.3=0,06.8+0,06.35,94R.3=0,06.8+0,06.3
--> R=27 --> Al
Các chất trong dd A gồm Al(NO3)3 và HNO3 dư
mdd sau phản ứng=5,94+592,2-0,06.44-0,06.30=593,7
CC
nHNO3 phản ứng=0,22.3+0,06.2+0,06=0,84 ( bảo toàn N)
--> CCHNO3 dư=(0,94−0,84).63593,7=1,06

Đặt nN2O = x; nNO = y
⇒ nkhí = x + y = 0,04 mol;
mkhí = 44x + 30y = 0,04 × 16,75 × 2.
Giải hệ có: x = 0,01 mol; y = 0,03 mol
nH+ dư = nNaOH = 0,04 mol.
Đặt nMg = x; nFe3O4 = y; nNH4NO3 = z
⇒ mX = 24x + 232y = 9,6(g).
Bảo toàn electron:
2x + y = 8z + 0,01 × 8 + 0,03 × 3
Lại có:
nH+ phản ứng = 2nO + 10nNH4+ + 10nN2O + 4nNO
⇒ 0,6 - 0,04 = 2 × 4y + 10z + 10 × 0,01 + 4 × 0,03
⇒ giải hệ có:
x = 0,11 mol; y = 0,03 mol; z = 0,01 mol.
A gồm Mg(NO3)2, Fe(NO3)3, NH4NO3, NaNO3.
mchất tan = 0,11 × 148 + 0,09 × 242 + 0,01 × 80 + 0,04 × 85 = 42,26(g)
Đáp án A

Chọn đáp án A
Đặt nN2O = x; nNO = y ⇒ nkhí = x + y = 0,04 mol; mkhí = 44x + 30y = 0,04 × 16,75 × 2.
Giải hệ có: x = 0,01 mol; y = 0,03 mol || nH+ dư = nNaOH = 0,04 mol.
Đặt nMg = x; nFe3O4 = y; nNH4NO3 = z ⇒ mX = 24x + 232y = 9,6(g). Bảo toàn electron:
2x + y = 8z + 0,01 × 8 + 0,03 × 3 || Lại có: nH+ phản ứng = 2nO + 10nNH4+ + 10nN2O + 4nNO
⇒ 0,6 - 0,04 = 2 × 4y + 10z + 10 × 0,01 + 4 × 0,03 ||⇒ giải hệ có:
x = 0,11 mol; y = 0,03 mol; z = 0,01 mol. A gồm Mg(NO3)2, Fe(NO3)3, NH4NO3, NaNO3.
► mchất tan = 0,11 × 148 + 0,09 × 242 + 0,01 × 80 + 0,04 × 85 = 42,26(g) ⇒ chọn A

Đáp án D
Gọi n là số oxi hóa của M trong sản phẩm tạo thành.
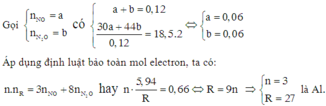

Xét hỗn hợp X có tỷ khối hơi so với H2 bằng 17,67 → n(NO) = n(NO2) = z (mol)
Trong hỗn hợp X gọi số mol FeO = x mol; Fe3O4 = y mol → 72x + 232 y = 33,2 gam (1)
Trong dung dịch Y có: Fe3+: x + 3y (mol); H+; K+ (1,2 mol); SO42- (1,2 mol) và NO3- (06 – 3z mol)
Xét phần I:
PTHH: H+ + OH- → H2O; Fe3+ + 3OH- → Fe(OH)3 (0,1 mol)
→ n(H+ dư) = 0,45 – 0,1*3 = 0,15 mol → n(H+ trong Y) = 0,3 mol
Áp dụng ĐLBT số mol e: (2) x + y = 2z*3 + z
Áp dụng ĐLBT điện tích: 3(x + 3y) + 0,3 + 1,2 = 1,2*2 + 0,6 – 3z
Giải (1) (2) (3) → x = 0,3; y = 0,05; z = 0,05 → Đáp án C

Chọn đáp án C

Dùng quy tắc đường chéo => nNO : nN2O = 2 : 1
Gọi số mol của NO và của N2O lần lượt là 2x và x (mol)
Phần 1: tác dụng với 0,45 mol NaOH → 0,1 mol Fe(OH)3
=> nOH- dùng để trung hòa H+ dư = 0,45 – 3nFe(OH)3 = 0,45 – 0,3 = 0,15 (mol)
=> nH+ dư = 0,15.2 = 0,3 (mol)
Ta có: ∑nH+ bđ = nKHSO4 + nHNO3 = 1,2 + 0,6 = 1,8 (mol)
BTNT H : => nH+ bđ = nH+ dư + 2nH2O => nH2O = ( 1,8 – 0,3)/2 = 0,75 (mol)
BTNT N : 0,6 = 2x + x + b
=> 3x + b = 0,6 (1)
BTĐT đối với các chất trong dd Y: 3a + 0,3+ 1,2 = 2.1,2 + b
=> 3a – b = 0,9 (2)
BTKL: mX + mKHSO4 + mHNO3 = mY + mZ + mH2O
=> 33,2 + 1,2. 136 + 0,6.63 = (56a+ 0,3+1,2.96 +62b+1,2.39) + ( 2x.30 + 46x) + 0,75.18
=> 56a+ 62b+106x=58, 4( 3)
Từ (1), (2), (3) => a= 0,45 ; b= 0,45; x = 0,05 (mol)
Phần 2: Tác dụng với Ba(OH)2 dư
=> m↓ = mBaSO4 + mFe(OH)3 = 0,6.233 + 0,225.107 = 163,875 (g) ( Bảo toàn nguyên tố SO4 và Fe)
Chú ý: Chia thành 2 phần nên phải chia đôi số liệu