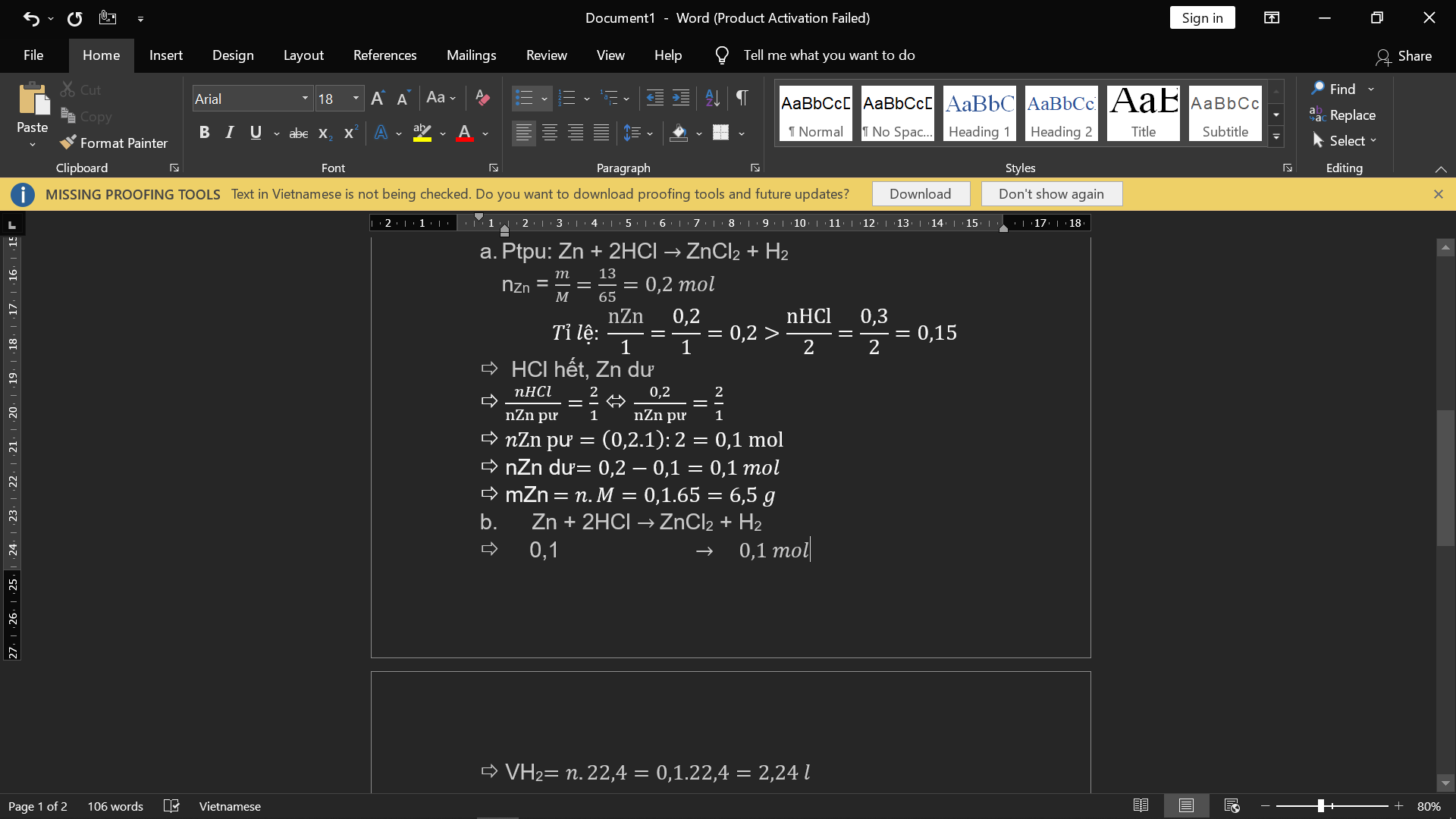
đốt cháy 3,36(l) C4H10 trong 13,44(l) O2.Tạo ra CO2và H2O
a, sau phản ứng chất nào dư?bao nhiêu lítb, tính m các chất thu được sau p/ứHãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) nC4H10= 0,15(mol)
nO2=0,6(mol)
PTHH: 2 C4H10 + 13 O2 -to-> 8 CO2 + 10 H2O
Ta có: 0,15/2 > 0,6/13
=> O2 hết, C4H10 dư, tính theo nO2
=> nC4H10(dư)= 0,15 - (0,6. 2/13)=3/52 (mol)
=>V(C4H10 dư, đktc)= 3/52. 22,4=1,292(l)
b) Các chất thu được sau p.ứ: CO2,H2O và C4H10 dư
mCO2=nCO2.44= (8/13. 0,6).44=16,246(g)
mH2O=nH2O.18= (10/13.0,6).18=8,308(g)
mC4H10(dư)= 3/52 . 58=3,346(g)

\(n_{Fe}=\dfrac{12.6}{56}=0.225\left(mol\right)\)
\(n_{O_2}=\dfrac{4.2}{22.4}=0.1875\left(mol\right)\)
\(3Fe+2O_2\underrightarrow{^{^{t^0}}}Fe_3O_4\)
\(3.........2\)
\(0.225......0.1875\)
Lập tỉ lệ : \(\dfrac{0.225}{3}< \dfrac{0.1875}{2}\Rightarrow O_2dư\)
\(m_{O_2\left(dư\right)}=\left(0.1875-0.225\cdot\dfrac{2}{3}\right)\cdot32=1.2\left(g\right)\)
\(m_{Fe_3O_4}=\dfrac{0.225}{3}\cdot232=17.4\left(g\right)\)

Bài 1:
a) nP=6,2/31=0,2(mol); nO2= 6,72/22,4=0,3(mol)
PTHH: 4P + 5 O2 -to-> 2 P2O5
Ta có: 0,2/4 < 0,3/5
=> P hết, O2 dư, tính theo nP
=> nO2(p.ứ)= 5/4. nP= 5/4. 0,2=0,25(mol)
=> mO2(dư)=0,3- 0,25=0,05(mol)
=> mO2(dư)=0,05.32=1,6(g)
b) nP2O5= nP/2= 0,2/2=0,1(mol)
=>mP2O5=0,1.142=14,2(g)

\(a,PTHH:4Al+3O_2\underrightarrow{t^o}2Al_2O_3\\ n_{Al}=\dfrac{m}{M}=\dfrac{10,8}{27}=0,4\left(mol\right)\\ Theo.PTHH:n_{Al_2O_3}=\dfrac{1}{2}.n_{Al}=\dfrac{1}{2}.0,4=0,2\left(mol\right)\\ m_{Al_2O_3}=n.M=0,2.102=20,4\left(g\right)\)
\(b,n_{O_2}=\dfrac{V_{\left(đktc\right)}}{22,4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ Lập.tỉ.lệ:\dfrac{n_{Al}}{4}>\dfrac{n_{O_2}}{3}\Rightarrow Al.dư\\ Theo.PTHH:n_{Al\left(pư\right)}=\dfrac{4}{3}.n_{O_2}=\dfrac{4}{3}.0,2\left(mol\right)\\ n_{Al\left(dư\right)}=n_{Al\left(bđ\right)}-n_{Al\left(pư\right)}=0,4-0,2=0,2\left(mol\right)\\ Theo.PTHH:n_{Al_2O_3}=\dfrac{1}{2}.n_{Al}=\dfrac{1}{2}.0,2=0,1\left(mol\right)\\ m_{Al_2O_3}=n.M=0,1=102=10,2\left(g\right)\)

\(n_P=\dfrac{6.2}{31}=0.2\left(mol\right)\)
\(n_{O_2}=\dfrac{6.72}{22.4}=0.3\left(mol\right)\)
\(4P+5O_2\underrightarrow{t^0}2P_2O_5\)
\(0.2.......0.25.........0.1\)
\(V_{O_2\left(dư\right)}=\left(0.3-0.25\right)\cdot22.4=1.12\left(l\right)\)
\(m_{P_2O_5}=0.1\cdot142=14.2\left(g\right)\)
PT: \(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
a, Ta có: \(n_P=\dfrac{6,2}{31}=0,2\left(mol\right)\)
\(n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,2}{4}< \dfrac{0,3}{5}\), ta được O2 dư.
Theo PT: \(n_{O_2\left(pư\right)}=\dfrac{5}{4}n_P=0,25\left(mol\right)\)
\(\Rightarrow n_{O_2\left(dư\right)}=0,05\left(mol\right)\)
\(\Rightarrow V_{O_2\left(dư\right)}=0,05.22,4=1,12\left(l\right)\)
b, Theo PT: \(n_{P_2O_5}=\dfrac{1}{2}n_P=0,1\left(mol\right)\)
\(\Rightarrow m_{P_2O_5}=0,1.142=14,2\left(g\right)\)
Bạn tham khảo nhé!

a) $n_P = \dfrac{12,4}{31} = 0,4(mol) ; n_{O_2} = \dfrac{13,44}{22,4} = 0,6(mol)$
$4P + 5O_2 \xrightarrow{t^o} 2P_2O_5$
Ta thấy :
$n_P : 4 < n_{O_2} : 5$ nên $O_2$ dư
Điphotpho pentaoxit được tạo thành
$n_{P_2O_5} = \dfrac{1}{2}n_P = 0,2(mol)$
$m_{P_2O_5} = 0,2.142 = 28,4(gam)$

\(a)\\ n_{O_2} = \dfrac{6,72}{22,4} = 0,3(mol)\\ 4P + 5O_2 \xrightarrow{t^o} 2P_2O_5\\ \dfrac{n_P}{4} = 0,05 < \dfrac{n_{O_2}}{5} = 0,06\)
Do đó, Oxi dư.
\(n_{O_2\ pư} = \dfrac{5}{4}n_P = 0,25(mol)\\ \Rightarrow m_{O_2\ dư} = (0,3 - 0,25).32 = 1,6(gam)\\ b)\\ n_{P_2O_5} = \dfrac{n_P}{2} = 0,1(mol)\\ \Rightarrow m_{P_2O_5} = 0,1.142 = 14,2(gam)\)
nC4H10 = 0.15 (mol)
nO2 = 0.6 (mol)
C4H10 + 13/2O2 -to-> 4CO2 + 5H2O
Bđ: 0.15_____0.6
Pư : 6/65_____0.6_______24/65___6/13
Kt : 3/52_____0__________24/65___6/13
VC4H10 dư = 1.29 (l)
mCO2 = 24/65*44= 16.24g
mH2O = 6/13*18=8.31 (g)
ĐỀ HỎI CÁC CHẤT SAU PHẢN ỨNG KHÔNG HỎI SẢN PHẨM NÊN LÀM NHƯ NÀY NHA!