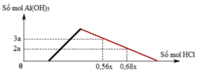
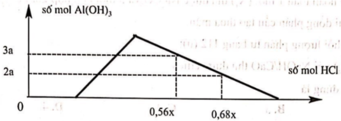
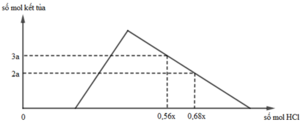
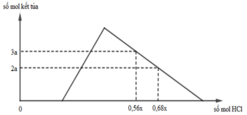
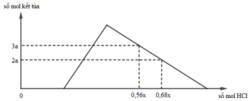
Hỗn hợp X gồm CaC2, Al4C3, Ca, Al. Cho 40,3 gam X vào nước dư chỉ thu được dung dịch Y và hỗn hợp khí Z gồm ba khí. Đốt cháy Z, thu được 20,16 lít CO2 ở đktc và 20,7 gam H2O. Nhỏ từ từ dung dịch HCl xM vào dung dịch Y, kết quả được biểu diễn theo đồ thị sau:
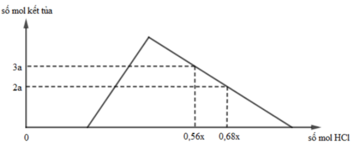
Giá trị của x là
A. 2,0
B. 2,5.
C. 1,8.
D. 1,5.




Đáp án B
► Quy X về Al, Ca và C.
Dễ thấy C kiểu gì cũng đi hết
vô khí và khi đốt khí thì đi vào CO2
⇒ nC = nCO2 = 0,9 mol
Đặt nAl = m; nCa = n
⇒ mX = 27m + 40n + 0,9 × 12 = 40,3(g)
BTNT(O) ⇒ nO2 = 1,475 mol.
BT electron: 3m + 2n + 0,9 × 4 = 1,475 × 4
⇒ Giải hệ cho:
m = 0,5 mol; n = 0,4 mol
► Dễ thấy Y gồm Ca2+, AlO2–, OH–
⇒ nCa2+ = 0,4 mol; nAlO2– = 0,5 mol.
BTĐT: nOH– = 0,3 mol. Nhìn đồ thị
⇒ Cả 2 TH trên thì HCl đều dư
và hòa tan 1 phần ↓
⇒ Ta có CT: nH+ = 4nAlO2– – 3n↓
(với H⁺ chỉ tính phần pứ với AlO₂⁻ và Al(OH)3)
► Áp dụng: (0,56x – 0,3) = 4 × 0,5 – 3 × 3a
và (0,68x – 0,3) = 4 × 0,5 – 3 × 2a
⇒ giải hệ có: x = 2,5; a = 1