Cho 50,0 gam hỗn hợp X gồm Fe3O4, Cu và Mg vào dung dịch HCl loãng dư, sau phản ứng được 2,24 lít H2 (đktc) và còn lại 18,0 gam chất rắn không tan. Phần trăm khối lượng Fe3O4 trong X là
A. 59,2%.
B. 25,92%.
C. 46,4%.
D. 52,9%.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
HCl dư => Fe3O4 tan hết.
Vẫn còn chất rắn không tan => Cu dư và chỉ có muối Fe2+; Cu2+
Fe3O4 + 8HCl -> 2FeCl3 + FeCl2 + 4H2O
2FeCl3 + Cu -> 2FeCl2 + CuCl2
=> nFe3O4 = nCu pứ. Và mFe3O4 + mCu pứ = 50 – 20,4
=> nFe3O4 = 0,1 mol => mCu = 50 – 232.0,1 = 26,8g
=> %mCu = 53,6%
=>A

Đáp án D
Các phản ứng xảy ra:
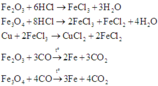
Nhận thấy: nO giảm = n O ( X ) = 1 2 n H C l = 0 , 5
⇒ a = m r ắ n s a u p h ả n ứ n g + m O g i ả m = 50 ( g a m )
Để tính được phần trăm khối lượng của Cu trong hỗn hợp X ta cần biết thêm khối lượng của Cu trong X.
Khi cho X vào dung dịch HCl dư thì chất rắn không tan còn lại sau phản ứng là Cu dư.
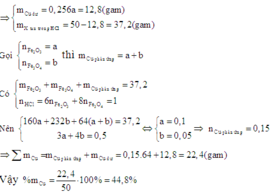

Đáp án A
Vì còn lại một phần chất rắn không tan nên Cu dư và trong dung dịch chứa FeCl2 và CuCl2
Có nO(A) = 0,5nHCl = 0,5
a = mkim loại + mO(A) = 42 + 16.0,5 = 50 (gam)
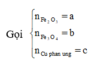
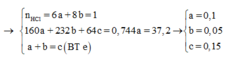
![]()