Hòa tan hoàn toàn m gam Al vào dung dịch HNO3 rất loãng thu được hỗn hợp khí gồm 0,15 mol N2O và 0,1 mol NO. Giá trị của m là:
A. 0,81.
B. 1,35.
C. 8,1.
D. 13,5.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Bảo toàn ne => 3nAl = 8nN2O + 3nNO => nAl = 0,5 => mAl = 13,5g

Đáp án D
ne = 3nAl = 3nNO + 8nN2O = 3.0,1 + 8.0,15 = 1,5 mol => nAl = 0,5 mol
=> m = mAl = 27.0,5 = 13,5g

Đáp án A
Bảo toàn ne => 3nAl = nNO2 + 3nNO
=> nAl = 0,12 => mAl = 3,24g

Bảo toàn ne ⇒ 3nAl = nNO2 + 3nNO ⇒ nAl = 0,06 ⇒ mAl = 1,62g ⇒ Chọn C.

Chọn C
Bảo toàn ne ⇒ 3nAl = nNO2 + 3nNO ⇒ nAl = 0,06 ⇒ mAl = 1,62g

Bảo toàn ne ⇒ 3nAl = nNO2 + 3nNO ⇒ nAl = 0,12 ⇒ mAl = 3,24g ⇒ Chọn A.

Số mol Al là: ![]()
Trộn Al và X không có phản ứng hóa học xảy ra ![]()
*Xét giai đoạn dung dịch Z tác dụng với AgNO3 dư:
Dung dịch Z tác dụng với AgNO3 thu được khí NO => Z chứa Fe2+ và H+ (*)
Z chứa Fe2+ và H+ => Z không chứa N O 3 - (**)
Từ (*) và (**) => Dung dịch Z gồm: ![]()
Các phản ứng tạo kết tủa:
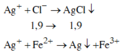
=> Kết tủa: 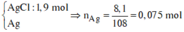
Các quá trình nhường, nhận electron:
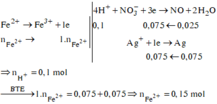
![]()
![]()
![]()
![]()
*Xét giai đoạn Y tác dụng với dung dịch HCl, HNO3:
Sơ đồ phản ứng:
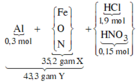
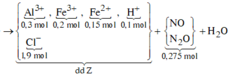
![]()
![]()
![]()
![]()
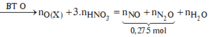
![]()
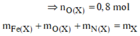
![]()
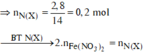
![]()
![]()
Đáp án B.
Bảo toàn ne⇒ 3nAl = 8nN2O + 3nNO⇒ nAl = 0,5 ⇒ mAl = 13,5g ⇒ Chọn D.