Tiến hành điện phân dung dịch chứa bằng điện cực trơ với cường độ dòng điện không đổi I=5A trong 6176 giây thì dừng điện phân thấy khối lượng dung dịch giảm 15 gam. Cho 0,25 mol Fe vào dung dịch sau điện phân , kết thúc phản ứng thấy khí NO thoát ra (sản phẩm khử duy nhất của N) đồng thời thu được m gam hỗn hợp rắn. giá trị m là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án B.
Dung dịch điện phân chứa 3x mol Cu(NO3)2 và x mol KCl.
Áp dụng định luật điện phân Faraday, ta có ne trao đổi = It : 96500 = 0,32 mol.
Dung dịch điện phân ra x mol CuCl2 và y mol CuO. Ta có: 2x + 2y = 0,32 mol và 135x + 80y = 15 gam
Giải hệ được x = 0,04 mol và y = 0,12 mol
→ dung dịch sau điện phân có Cu(NO3)2; KNO3 và HNO3.
Bảo toàn nguyên tố H có nH2O = 0,12 mol → bảo toàn nguyên tố O có nNO = 0,06 mol.
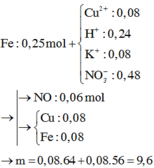
Tiếp tục bảo toàn N suy ra số mol Fe(NO3)2 là 0,17 mol. Bảo toàn khối lượng kim loại ta có:0,25 x 56 + 0,08 x 64 = 0,17 x 56 + m → m = 9,6 gam

Đáp án B
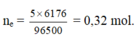
Fe + dung dịch sau điện phân → sinh khí NO
⇒ dung dịch sau điện phân chứa H+⇒ Cl– bị điện phân hết.
► Quy đổi sản phẩm điện phân về CuO và CuCl2 với số mol x và y.
ne = 2x + 2y = 0,32 mol; mdung dịch giảm = 80x + 135y = 15(g).
||⇒ giải hệ có: x = 0,12 mol; y = 0,04 mol ⇒ nKCl = nCl– = 2y = 0,08 mol.
⇒ nCu2+ = nCu(NO3)2 = 0,08 × 3 = 0,24 mol ⇒ nCu2+/dung dịch = 0,08 mol.
nO2 = 0,5x = 0,06 mol ⇒ nH+ = 0,06 × 4 = 0,24 mol.
► 4H+ + NO3– + 3e → NO + 2H2O || Cu2+ + 2e → Cu.
ne nhận tối đa = 3/4nH+ + 2nCu2+ = 0,34 mol < ne cho tối thiểu = 2nFe = 0,5 mol.
||⇒ Fe dư ⇒ Fe chỉ lên số oxi hóa +2 ⇒ nFe phản ứng = 0,34 ÷ 2 = 0,17 mol.
► Hỗn hợp rắn gồm 0,08 mol Fe và 0,08 mol Cu ⇒ m = 9,6(g).

Đáp án B
Dung dịch điện phân chứa 3x mol Cu(NO3)2 và x mol KCl.
Áp dụng định luật điện phân Faraday, ta có ne trao đổi = It ¸ 96500 = 0,32 mol.
Dung dịch điện phân ra x mol CuCl2 và y mol CuO. Ta có: 2x + 2y = 0,32 mol và 135x + 80y = 15 gam.
Giải hệ được x = 0,04 mol và y = 0,12 mol.
® dung dịch sau điện phân có Cu(NO3)2; KNO3 và HNO3.
Bảo toàn nguyên tố H có nH2O = 0,12 mol ® bảo toàn nguyên tố O có nNO = 0,06 mol.
Tiếp tục bảo toàn N suy ra số mol Fe(NO3)2 là 0,17 mol. Bảo toàn khối lượng kim loại ta có: 0,25 x 56 + 0,08 x 64 = 0,17 x 56 + m →m = 9,6 gam

Đáp án B
ne = 5 x 6176 / 96500 = 0,32 mol. Fe+ dung dịch sau điện phân → sinh khí NO
⇒ dung dịch sau điện phân chứa H+ ⇒ Cl– bị điện phân hết.
► Quy đổi sản phẩm điện phân về CuO và CuCl2 với số mol x và y.
ne = 2x + 2y = 0,32 mol; mdung dịch giảm = 80x + 135y = 15(g).
⇒ giải hệ có: x = 0,12 mol; y = 0,04 mol ⇒ nKCl = nCl– = 2y = 0,08 mol.
⇒ nCu2+ = nCu(NO3)2 = 0,08 × 3 = 0,24 mol ⇒ nCu2+/dung dịch = 0,08 mol.
nO2 = 0,5x = 0,06 mol ⇒ nH+ = 0,06 × 4 = 0,24 mol.
► 4H+ + NO3– + 3e → NO + 2H2O
Cu2+ + 2e → Cu.
ne nhận tối đa = 3/4nH+ + 2nCu2+ = 0,34 mol < ne cho tối thiểu = 2nFe = 0,5 mol.
⇒ Fe dư ⇒ Fe chỉ lên số oxi hóa +2 ⇒ nFe phản ứng = 0,34 ÷ 2 = 0,17 mol.
► Hỗn hợp rắn gồm 0,08 mol Fe và 0,08 mol Cu ⇒ m = 9,6(g)

Đáp án C
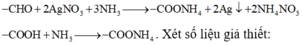
M à ∑ g ố c m u ố i N H 4 + n = 0 , 02 m o l ⇒ n N H 4 + t ạ o t h à n h t ừ a x i t = 0 , 02 - 0 , 01875 = 0 , 00125 m o l
So sánh khối lượng của X và muối amoni (CHO với COONH4; COOH với COONH4)
Khối lượng tăng từ phản ứng tráng bạc = 0,01875*(62-29) = 0,61875 gam
Khối lượng tăng từ axit = 0,00125*(62-45) = 0,02125 gam.
Theo đó, giá trị m = 1,86 - ( 0,61875- 0,02125) = 1,22 gam

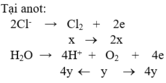






Đáp án B