Có 3 dung dịch hỗn hợp X (NaHCO3 và Na2CO3); Y (NaHCO3 và Na2SO4); Z (Na2CO3 và Na2SO4). Để nhận biết được 3 dung dịch trên, cần dùng 2 dung dịch là:
A. NaOH và NaCl
B. NH3 và NH4Cl
C. HCl và NaCl
D. HNO3 và Ba(NO3)2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn B
Cho Ba2+ vào các dung dịch đều thu được kết tủa. Ta đi xử lí kết tủa.
Ống 1 chỉ có BaCO3 gặp HNO3 tan hết. Ống 2 chỉ có BaSO4 không bị tan.
Ống 3 có BaCO3 và BaSO4 gặp HNO3 bị tan một phần.

Đáp án C
Cho dung dịch Ba(NO3)2 vào các dung dịch trên:
Ở cả 3 dung dịch đều xuất hiện kết tủa trắng:
- Ống nghiệm 1:
Ba(NO3)2+ Na2CO3 → BaCO3 ↓ + 2NaNO3
- Ống nghiệm 2:
Ba(NO3)2+ Na2SO4 → BaSO4 ↓ + 2NaNO3
-Ống nghiệm 3:
Ba(NO3)2+ Na2CO3 → BaCO3 ↓ + 2NaNO3
Ba(NO3)2+ Na2SO4 → BaSO4 ↓ + 2NaNO3
Sau đó cho dung dịch HNO3 lần lượt vào các ống nghiệm trên:
- Ống nghiệm nào kết tủa tan hoàn toàn thì đó là BaCO3 → Ống nghiệm ban đầu chứa NaHCO3+ Na2CO3
2HNO3+ BaCO3 → Ba(NO3)2+ CO2+ H2O
- Ống nghiệm nào kết tủa không tan thì đó là BaSO4 → Ống nghiệm ban đầu chứa NaHCO3+ Na2SO4
- Ống nghiệm nào kết tủa tan 1 phần thì đó là BaCO3, BaSO4 → Ống nghiệm ban đầu chứa Na2CO3+ Na2SO4
2HNO3+ BaCO3 → Ba(NO3)2+ CO2+ H2O

Nhỏ từ từ HCl vào 3 mẫu thử.
+ Lọ nào không xuất hiện khí ngay là Na2CO3 và K2SO4.
+ Hai lọ còn lại tạo khí ngay lập tức
Nhỏ BaCl2 vào hai lọ còn lại tới khi thấy kết tủa không tăng thì đem nhỏ HCl tới dư.
+ Lọ nào vẫn cho kết tủa thì chứa NaHCO3 và K2SO4
+ Lọ còn lại chứa Na2CO3 và NaHCO3

Chọn đáp án C
Với cặp dung dịch Ba(OH)2 ta có thêm chất thử nữa là BaCl2

Chọn đáp án C
Với cặp dung dịch Ba(OH)2 ta có thêm chất thử nữa là BaCl2
Dùng BaCl2 để phân biệt NaHCO3 và Na2CO3 B a 2 + + C O 3 2 - → C a C O 3
Dùng BaCl2 để phân biệt NaHCO3 và Na2SO4 B a 2 + + S O 4 2 - → B a S O 4
Dùng HCl để phân biệt Na2CO3 và Na2SO4 2 H + + C O 3 2 - → C O 2 + H 2 O

Đáp án D
Ta có: nHCl= 0,45 mol; n C O 2 = 5,6/22,4= 0,25 mol.
Giả sử ban đầu có x mol NaHCO3
CO32- + H+ → HCO3- (1)
HCO3-+ H+ → CO2+ H2O (2)
0,25 0,25 ←0,25
Theo PT (2): n H C O 3 - = n H + = n C O 2 = 0,25 mol
→ n H + PT1 = 0,45- 0,25 = 0,2 mol
→ n C O 3 2 - PT1 = n H + = n H C O 3 - PT1 = 0,2 mol
→ n N a 2 C O 3 = n C O 3 2 - PT1= 0,2 mol
→ C M N a 2 C O 3 = 0,2/ 0,5 = 0,4M
Dung dịch Y chứa Na+, HCO3- dư: x+0,2- 0,25= x- 0,05 mol
HCO3-+ OH- → CO32-+ H2O
Ba2++ CO32- → BaCO3
Ta thấy: n H C O 3 - = n C O 3 2 - = n B a C O 3 = 19,7/197 = 0,1 mol
→ x- 0,05 = 0,1 → x = 0,15 mol
→ C M N a H C O 3 = 0,15/ 0,5 = 0,3M

\(n_{HCl}=0,3\cdot0,5=0,15mol\\ n_{CO_2}=\dfrac{1,12}{22,4}=0,05mol\\ n_{CaCO_3}=\dfrac{20}{100}=0,2mol\\ n_{Na_2CO_3}=x;n_{NaHCO_3}=y\\ 0,15=x+0,05\\ x=0,1\\ BTNT:\\ 0,2+0,05=x+y\\ y=0,25-0,1=0,15\\ a=0,1\cdot106+0,15\cdot84=23,2g\)
\(n_{HCl}=0,3.0,5=0,15\left(mol\right)\\ n_{CO_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\\ n_{CaCO_3}=\dfrac{20}{100}=0,2\left(mol\right)\)
Phản ứng xảy ra theo thứ tự:
\(HCl+Na_2CO_3\rightarrow NaHCO_3+NaCl\) (1)
0,1--->0,1--------->0,1
\(HCl+NaHCO_3\rightarrow NaCl+H_2O+CO_2\) (2)
0,05<--0,05<-----------------------------0,05
Vì X + \(Ca\left(OH\right)_2\) dư tạo kết tủa => \(NaHCO_3\) dư, \(HCl\) hết.
\(Ca\left(OH\right)_2+2NaHCO_3\rightarrow CaCO_3\downarrow+Na_2CO_3+2H_2O\)
0,4<--------0,2
\(a=m_{Na_2CO_3}+m_{NaHCO_3}=106.0,1+84\left(0,05+0,4-0,1\right)=40\left(g\right)\)

Đáp án B
Chú ý đổ từ từ muối Na2CO3 và NaHCO3 vào dung dịch H2SO4 thì xảy ra đồng thời các phương trình
2H+ + CO32- → CO2 + H2O (1)
2x------> x
H+ + HCO3- → CO2 + H2O (2)
y -----> y
Ta có 2x+ y = 0,3 mol
Vì phản ứng xảy ra đồng thời nên x: y = nCO32- : nHCO3- = 0,75 : 0,5 = 3:2
Ta có hệ :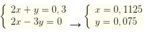
Vậy nCO2 = 0,1125 + 0,075 = 0,1875 mol → V= 4,2 lít. Đáp án B
Đáp án D
HNO3 và Ba(NO3)2