Cho m gam P2O5 vào dung dịch chứa 0,1 mol NaOH và 0,05 mol KOH, thu được dung dịch X. Cô cạn X, thu được 8,56 gam hỗn hợp chất rắn khan. Giá trị của m gần nhất với giá trị nào sau đây?
A. 1,8.
B. 2,9.
C. 4,5.
D. 2,7.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đặt nP= x mol, nOH- =0,15 mol
TH1: Axit dư, x > 0,15
Dễ thấy chất rắn gồm
(x-0,15)/2 mol P2O5, 0,1 mol NaH2PO4, 0,05 mol KH2PO4
→mrắn= 142. (x-0,15)/2+ 99.0,1+ 136.0,05 > 8,56 gam (Vô lí)
TH2: Kiềm dư, x < 0,15/3= 0,05
Chất rắn gồm: x mol PO43-, 0,15-3x mol OH-, 0,1 mol Na+, 0,05 mol K+
→ mrắn= 95x+ 17. (0,15-3x)+ 23.0,1+ 39.0,05= 8,56 gam
→ x= 0,04
Vậy nP2O5= 0,02 mol→m= 2,84 gam
TH3: Tạo hỗn hợp muối, 0,05 < x< 0,15
Chất rắn gồm:
H2PO4-, HPO42-, PO43- (hai trong 3 gốc này): x mol; K+: 0,05 mol, Na+: 0,1 mol
→mrắn= M.x+ 23.0,1+ 39.0,05
Vì x> 0,05 và M> 95 nên mrắn > 95.0,05+ 2,3+1,95=9 >8,56
→Không thỏa mãn
Đáp án D

Đáp án D
Giả sử kiềm có công thức chung là MOH (M=(0,1.23+0,05.39)/0,15=85/3)
Nếu phản ứng chỉ tạo 1 muối:
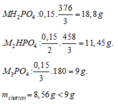
=> MOH dư, phản ứng tạo muối M3PO4.
Đặt nM3PO4=x mol, nMOH=y mol;
180x+136y/3=8,56
3x+y=nMOH=0,15
=> x=0,04, y=0,03.
=> nP2O5=0,04/2=0,02 mol
=> mP2O5=2,84 gam.

Đáp án B
Giả sử dung dịch kiềm có công thức chung là: MOH: 0,15 (mol) với
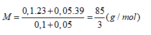
+ Nếu phản ứng chỉ tạo 1 muối:
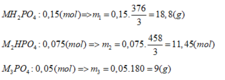
Ta thấy 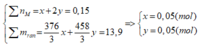
BTNT: P => nP = nMH2PO4 + nM2PO4 = 0,05 + 0,05 = 0,1 (mol)
=> nP2O5 = ½ nP = 0,05 (mol)
=> mP2O5 = 0,05. 142 = 7,1 (g)
Chọn B
mà 8,56 = 0,1.24 + 0,05.39 + 95a + 17.(0,15 – a) Þ a = 0,04 Þ m = 2,84 (g)