Cho phương trình hóa học :
aFe + bH2SO4 ->cFe2(SO4)3 + dSO2 + eH2O. Tỷ lệ a : b là :
A. 1 : 3
B. 1 : 2
C. 2 : 3
D. 2 : 9
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Quá trình oxi hóa - khử:
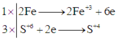
Kết quả
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ + 6H2O
⇒ a : b = n Fe : N H 2 SO 4 = 1 : 3

Quan sát phương trình phản ứng ta thấy Fe tăng từ mức oxi hóa 0 lên mức oxi hóa +3; S giảm từ mức oxi hóa +6 xuống mức oxi hóa +4 → Fe là chất khử và H2SO4 là chất oxi hóa.
2x F e 0 → F e 3 + + 3 e
3x 4 H + + S + 6 O 4 2 - + 2 e → S + 4 O 2 + 2 H 2 O
Suy ra phương trình phản ứng đã cân bằng như sau:
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ +6H2O
Chọn đáp án A

Chọn đáp án B.
Quan sát phương trình phản ứng ta thấy số oxi hóa của Al tăng từ 0 lên +3; số oxi hóa của S giảm từ +6 xuống +4 → Al là chất khử và H2SO4 là chất oxi hóa
2 x A l 0 → A l + 3 + 3 e
3 x S + 6 + 2 e → S + 4
Suy ra phương trình phản ứng đã cân bằng như sau:
2Al + 6H2SO4 → Al2(SO4)3 + 3SO2 + 6H2O
Chọn A
2Fe + 6H2SO4 -> Fe2(SO4)3 + 3SO2 + 6H2O