Hòa tan m gam Mg trong 500ml dung dịch chứa hỗn hợp H2SO4 0,4M và Cu(NO3)2 đến phản ứng hoàn toàn thu được 1,12 lít hỗn hợp khí X (đktc) có tỉ khối của X so với H2 là 6,2 gồm N2 và H2, dung dịch Y và 2 gam hỗn hợp kim loại. Giá trị m là
A. 6,68
B. 4,68
C. 5,08
D. 5,48

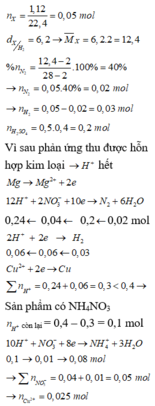
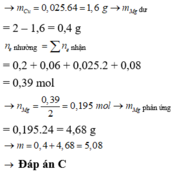
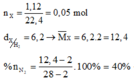
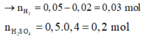

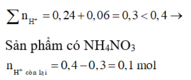
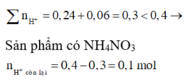
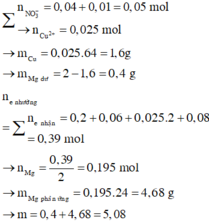
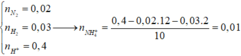


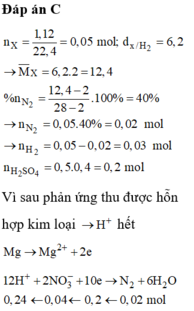

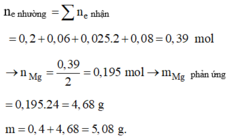

Đáp án : C
Xét 0,05 mol X : Áp dụng qui tắc đường chéo : nN2 = 0,02 mol ; nH2 = 0,03 mol
=> Giả sử phản ứng tạo NH4+ : x mol
=> nH+ = 12nN2 + 2nH2 + 10nNH4+
=> x = 0,01 mol
Do khí có H2 => NO3- phải hết trước H+
Sau phản ứng có hỗn hợp kim loại => Cu2+ ; H+ phản ứng hết
=> Trong dung dịch chỉ còn lại : NH4+ ; SO42- ; Mg2+
=> BT điện tích : nMg2+ = 0,195 mol
BT Nito : nNO3 = nN2.2 + nNH4+ = 0,05 mol => nCu2+ = 0,025 mol = nCu
=> mMg dư = 2 – 0,025.64 = 0,4g
=> m = mMg dư + 24. nMg pứ = mMg dư + 24nMg2+ ( dd) = 5,08g