Hỗn hợp X gồm 2 kim loại R và M đều ở chu kì 3. R có số hiệu nguyên tử nhỏ hơn M. Chia hỗn hợp X làm hai phần bằng nhau. Cho phần một vào nước dư, thu được V lít khí. Cho phần hai vào dung dịch NaOH dư, được 1,45V lít khí. Các khí đo cùng điều kiện nhiệt độ, áp suất. Tỉ lệ mol của R và M trong X tương ứng là:
A. 1:2.
B. 3:5
C. 5:8.
D. 3:7

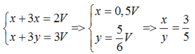
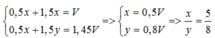





Chọn đáp án C
R là Natri (Na) và M là Nhôm (Al). Do số mol H2 ở 2 thí nghiệm khác nhau.
• phần 1: Al dư. Quy V lít về V mol. Xét phần 1 : Do Al dư ⇒ nAl phản ứng = nNa
⇒ Bảo toàn electron: nNa + 3nNa = 2nH2 ⇒ nNa = 2V ÷ 4 = 0,5V mol.
• Phần 2: NaOH dư ⇒ Al phản ứng hết. Bảo toàn electron:
nNa + 3nAl = 2nH2 ⇒ 0,5V + 3nAl = 2 × 1,45V ⇒ nAl = 0,8V mol.
⇒ nR : nM = 0,5 : 0,8 = 5 : 8.