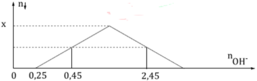
Nhỏ từ từ đến dư KOH vào dung dịch gồm a mol HCl và x mol ZnSO4 ta quan sát hiện tượng theo đồ thị hình bên (số liệu theo đơn vị mol). Giá trị x (mol) là:
A. 0,40
B. 0,60
C. 0,70
D. 0,65
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : B
Ta thấy từ nOH = 0,25mol thì mới có kết tủa => nHCl = 0,25 mol
Có 2 vị trí mà thu được lượng kết tủa như nhau :
+) Tại nOH = 0,45 mol => Zn2+ dư => nZn(OH)2 = ½ nOH = ½ (0,45 – 0,25) = 0,1 mol
+) Tại nOH = 2,45 mol => Zn(OH)2 tan 1 phần => 2nZn(OH)2 = 4nZn2+ - nOH
=> 2.0,1 = 4.x – (2,45 – 0,25)=> x = 0,6 mol

ĐÁP ÁN C
Tại nOH = 0,25 mol thì bắt đầu có kết tủa => Khi đó H+ trung hòa hết
=> a = 0,25 mol
Tại nOH = 0,45 mol thì có lượng kết tủa = với thời điểm nOH = 2,45 mol
+) nOH = 0,45 thì Zn2+ dư => nZn(OH)2 = ½ nOH = ½ (0,45 – 0,25) = 0,1 mol
+) nOH = 2,45 thì hòa tan kết tủa 1 phần : nZn(OH)2 = ½ [4nZn2+ - (nOH – nHCl) ]
=> nZn2+ = x = 0,6 mol

Giải thích:
Quan sát đồ thị ta thấy nCO2 = 0,15 thì kết tủa đạt max.
=> nCa(OH)2 = nCaCO3 max = 0,15
Khi nCO2 = 0,45 thì bắt đầu hòa tan kết tủa.
Khi nCO2 = 0,5 thì lượng kết tủa bị hòa tan là: nCaCO3 bị hòa tan = 0,5 - 0,45 = 0,05
=> nCaCO3 còn lại = x = 0,15 - 0,05 = 0,1
Đáp án A
Đáp án B