Nhiệt phân hoàn toàn m gam hỗn hợp gồm CaCO3 và Na2CO3 thu được 11,6 gam chất rắn và 2,24 lít khí (đktc). Hàm lượng % của CaCO3 trong X là
A. 6,25%.
B. 8,62%.
C. 50,2%.
D. 62,5%.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Na2CO3 không bị nhiệt phân, nên 2,24 lít khí sinh ra chính là CO2 do CaCO3 bị nhiệt phân theo phản ứng
![]()
Cách 1:
![]()
Áp dụng định luật bảo toàn khối lượng ta có:
m X = m c h ấ t r ắ n + m C O 2 = 11,6 + 0,1.44 = 16 (gam)
Vậy phần trăm khối lượng của CaCO3 trong hỗn hợp X là:
![]()
Cách 2:
Ta có:
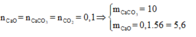
Hỗn hợp rắn thu được gồm CaO và Na2CO3
![]()
![]()
Đáp án D

Đáp án C
• Nhiệt phân hoàn toàn CaCO3, Na2CO3 được 11,6 gam chất rắn và 0,1 mol CO2![]()
nCO2 = 0,1 mol → nCaO = 0,1 mol → nCaO = 0,1 × 56 = 5,6 gam → mNa2CO3 = 11,6 - 5,6 = 6 gam; mCaCO3 = 0,1 × 100 = 10 gam
![]() → Đáp án đúng là đáp án C
→ Đáp án đúng là đáp án C

\(n_{CO_2}=\dfrac{2,24}{22,4}=0,1mol\)
\(CaCO_3\rightarrow\left(t^o\right)CaO+CO_2\)
0,1 0,1 0,1 ( mol )
\(m_{Na_2CO_3}=11,6-\left(0,1.56\right)=6g\)
\(m_{CaCO_3}=0,1.100=10g\)
\(\%m_{Na_2CO_3}=\dfrac{6}{10+6}.100=37,5\%\)

Đáp án D
nCO2= nCaCO3 = 0,15 mol
ð mCaCO3 = 15 gam
mX= mrắn + mCO2
= 17,4+ 0,15.44=24 gam
%mCaCO3= (15:24).100%=62,5%

Gọi số mol MgCO3, CaCO3 là a, b (mol)
=> 84a + 100b = 1,84 (1)
PTHH: MgCO3 --to--> MgO + CO2
a-------------------->a
CaCO3 --to--> CaO + CO2
b-------------------->b
=> a + b = \(\dfrac{0,448}{22,4}=0,02\) (2)
(1)(2) => a = 0,01 (mol); b = 0,01 (mol)
=> \(\left\{{}\begin{matrix}\%m_{MgCO_3}=\dfrac{0,01.84}{1,84}.100\%=45,65\%\\\%m_{CaCO_3}=\dfrac{0,01.100}{1,84}.100\%=54,35\%\end{matrix}\right.\)

Áp dụng định luật BTKL :
\(m_{CO_2}=142-76=66\left(g\right)\)
\(n_{CO_2}=\dfrac{66}{44}=1.5\left(mol\right)\)
\(V_{CO_2}=1.5\cdot22.4=33.6\left(l\right)\)
\(n_{CaCO_3}=a\left(mol\right),n_{MgCO_3}=b\left(mol\right)\)
\(m_X=100a+84b=142\left(g\right)\left(1\right)\)
\(CaCO_3\underrightarrow{^{^{t^0}}}CaO+CO_2\)
\(MgCO_3\underrightarrow{^{^{t^0}}}MgO+CO_2\)
\(m_Y=56a+40b=76\left(g\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=1,b=0.5\)
\(\%CaO=\dfrac{56\cdot1}{76}\cdot100\%=73.68\%\)
\(\%MgO=100-73.68=26.32\%\)
PTHH: \(CaCO_3\xrightarrow[]{t^o}CaO+CO_2\uparrow\)
a_______a_____a (mol)
\(MgCO_3\xrightarrow[]{t^o}MgO+CO_2\uparrow\)
b_______b_____b (mol)
Ta lập hệ phương trình: \(\left\{{}\begin{matrix}100a+84b=142\\56a+40b=76\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=1\\b=0,5\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CaO}=\dfrac{56}{76}\cdot100\%\approx73,68\%\\\%m_{MgO}=26,32\%\\V_{CO_2}=\left(1+0,5\right)\cdot22,4=33,6\left(l\right)\end{matrix}\right.\)
Đáp án D
Na2CO3 bền với nhiệt nên không bị nhiệt phân.
%mCaCO3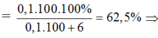
%mCaCO3 = Chọn D.