Đốt cháy hoàn toàn m gam photpho trong không khí (dư) rồi hòa tan toàn bộ sản phẩm thu được vào 500 ml dung dịch H3PO4 85% (D=1,7g/ml) thì nồng độ H3PO4 trong dung dịch tăng thêm 4,1%. Giá trị của m là
A. 18,6.
B. 24,8.
C. 31,0.
D. 37,2.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(4P+ 5O_2 \xrightarrow{t^o} 2P_2O_5\\ P_2O_5 + 3H_2O \to 2H_3PO_4\)
\(n_{P_2O_5} = 0,5n_P = 0,5a(mol)\)
\(n_{H_3PO_4} = n_P = a(mol)\)
\(m_{dung\ dịch} = 500.1,7 = 850(gam)\\ m_{H_3PO_4} = 500.1,7.85\% = 722,5(gam)\\\)
Sau khi thêm sản phẩm cháy vào :
\(m_{H_3PO_4} = 722,5 + 98a(gam)\\ m_{dung\ dịch} = m_{dd\ trước} + m_{P_2O_5} = 850 + 71a(gam)\)
Suy ra :
\(C\%_{H_3PO_4} = \dfrac{722,5+98a}{850+71a}.100\% = 85\% + 7,6\%\\ \Rightarrow a = 2\)
Suy ra: m = 2.31 = 62(gam)

Photpho cháy trong không khí lấy dư theo phản ứng :
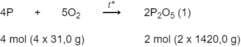
P 2 O 5 tác dụng với tạo thành H 3 P O 4 theo phản ứng :
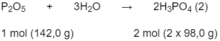
Theo phản ứng (1): 4 x 31,0 g P tạo ra 2 x 142,0 g P 2 O 5
a g P tạo ra 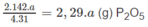
Theo các phản ứng (1) và (2) :
4 x 31,0 (g) P tạo ra 4 x 98,0 (g) H 3 P O 4
a (g) P tạo ra 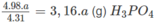
Khối lượng H 3 P O 4 có trong 500,0 ml dung dịch 85,00% :
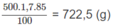
Khối lượng H 3 P O 4 sau khi đã hoà tan P 2 O 5 : 722,5 g + 3,16 x a g.
Khối lượng của dung dịch H 3 P O 4 sau khi đã hoà tan P 2 O 5 :
500,0 x 1,7 g + 2,29 x a g = 850,0 g + 2,29 x a g
Ta có phương trình về nồng độ phần trăm của dung dịch H 3 P O 4 :
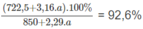
Giải phương trình được a = 62,16 g photpho.
Đáp án C