Hòa tan hoàn toàn 5,56g FeSO4.7H2O vào nước được dung dịch X, X tác dụng vừa đủ với V (ml) dung dịch KMnO4 0,1M (có H2SO4 loãng dư làm môi trường). Giá trị của V là:
A. 20,0
B. 35,0
C. 40,0
D. 30,0
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Cách 1: Viết phản ứng, cân bằng hệ số và tính toán theo yêu cầu:
Các phản ứng xảy ra như sau:
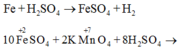
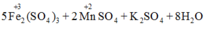
Do đó

Cách 2: Áp dụng phương pháp bảo toàn mol electron:
Ta có: ![]() (bảo toàn nguyên tố Fe)
(bảo toàn nguyên tố Fe)


Đáp án A:
H2SO4 loãng không nhận electron của hỗn hợp mà chỉ có KMnO4 nhận electron.
Bảo toàn electron cho toàn bộ quá trình
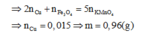

Fe + H2SO4 → FeSO4 + H2
Dung dịch X gồm FeSO4 và H2SO4 dư
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
nKMnO4 = 0,1. 0,2 =0,02 mol
Theo tỉ lệ phản ứng => nFeSO4 = 5nKMnO4 = 0,02.5 = 0,1 mol
=> nFe = nFeSO4 = 0,1 mol và mFe = 0,1.56 = 5,6 gam
Đáp án C
nFeSO4 = nFeSO4.7H2O = 5,56: 278 = 0,02 mol
Fe+2 → Fe+3 + 1e
Mn+7 + 5e → Mn+2
=> Bảo toàn electron: nFeSO4 = 5nKMnO4 => nKMnO4 = 0,02: 5 = 0,004 mol
=> Vdd KMnO4 = 0,004: 0,1 = 0,04 lít = 40 ml