Trộn 100ml dung dịch H2SO4 0,25M với 200ml dung dịch NaOH 0,1M được dung dịch X. pH của dung dịch X là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án C
nH+ = 0,02 mol; nOH-= 0,04 mol
H+ + OH- → H2O
0,02 0,04
nOH- dư = 0,02 mol; [OH-] dư = 0,02/0,2 = 0,1M suy ra [H+] = 10-13 M suy ra pH = 13

Đáp án B
nOH-= 0,03 mol; nBa2+ = 0,01 mol
nH+ = 0,035 mol; nSO4(2-) = 0,015 mol
H+ + OH- → H2O
0,035 0,03
nH+ dư = 5.10-3 mol; [H+] dư = 5.10-3/0,5 = 0,01 suy ra pH = 2

Ta có: \(\Sigma n_{H^+}=0,1.0,1.2+0,1.0,2=0,04\left(mol\right)\)
\(\Sigma n_{OH^-}=0,1.0,2+0,1.0,1.2=0,04\left(mol\right)\)
PT ion: \(H^++OH^-\rightarrow H_2O\)
_____0,04____0,04_________ (mol)
⇒ H+ pư vừa đủ với OH-
⇒ a = pH = 7
Ta có: \(n_{SO_4^{2-}}=0,1.0,1=0,01\left(mol\right)\)
\(n_{Ba^{2+}}=0,1.0,1=0,01\left(mol\right)\)
PT ion: \(SO_4^{2-}+Ba^{2+}\rightarrow BaSO_{4\downarrow}\)
_______0,01___0,01______0,01___ (mol)
\(\Rightarrow m=m_{BaSO_4}=0,01.233=2,33\left(g\right)\)
Bạn tham khảo nhé!

nHCl = 0,2.0,1 = 0,02 (mol)
nH2SO4 = 0,1.0,1 = 0,01 (mol)
=> nH+ = 0,02.1 + 0,01.2 = 0,04 (mol)
\(C_{M\left(H^+\right)}=\dfrac{0,04}{0,2+0,1}=0,1333M\)
=> pH = -log(0,1333) = 0,875

\(n_{H^+}=0.2\cdot0.01\cdot2=0.004\left(mol\right)\)
\(n_{OH^-}=0.1\cdot0.01=0.001\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
\(0.001.....0.001\)
\(n_{H^+\left(dư\right)}=0.004-0.001=0.003\left(mol\right)\)
\(pH=-log\left(H^+\right)=-log\left(\dfrac{0.003}{0.2+0.1}\right)=2\)
Có: \(n_{H^+}=2n_{H_2SO_4}=2.0,2.0,01=0,004\left(mol\right)\)
\(n_{OH^-}=0,1.0,01=0,001\left(mol\right)\)
PT ion: \(H^++OH^-\rightarrow H_2O\)
____0,004___0,001 (mol)
\(\Rightarrow n_{H^+\left(dư\right)}=0,003\left(mol\right)\)\\(\Rightarrow\left[H^+\right]=\dfrac{0,003}{0,3}=0,01\)
\(\Rightarrow pH=2\)
Bạn tham khảo nhé!
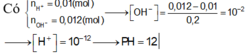
H2SO4 và NaOH là các chất điện li mạnh nên điện li hoàn toàn thành ion.
nH2SO4 = 0,025 mol → nH+ = 2nH2SO4 = 0,05 mol
nNaOH = 0,02 mol → nOH- = nNaOH = 0,02 mol
PT ion: H+ + OH- → H2O
Ban đầu: 0,05 0,02 mol
Pư: 0,02 ← 0,02
Sau pư: 0,03 0 mol
→ [H+] = n/V = 0,03/(0,1 + 0,2) = 0,1M → pH = -log [H+] = 1