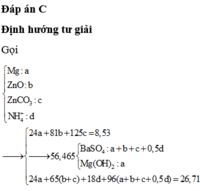
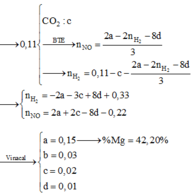
Cho hỗn hợp X chứa Mg; FeO; Fe(OH)2; Cu; FeCO3 trong đó các kim loại đơn chất chiếm 31,683% về khối lượng. Hòa tan hoàn toàn 28,28 gam X trong dung dịch Y chứa 0,21 mol KNO3 và 1,16 mol HCl thu được dung dịch Z chỉ chứa các muối clorua; nitrat của kim loại và hỗn hợp khí A chứa 0,03 mol CO2 và z mol N2. Thêm NaOH vừa đủ vào Z, lọc bỏ phần kết tủa thì thu được dung dịch T chứa 78,87 gam muối. Biết Z không phản ứng với HCl. Phần trăm khối lượng Fe(OH)2 trong X gần nhất với giá trị nào sau đây?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

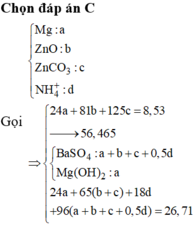
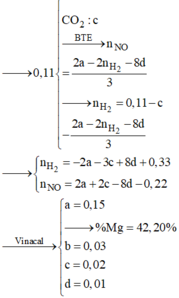
| CHÚ Ý |
| Đây là bài toán đòi hỏi khá cao về kỹ năng đặt ẩn, biến đổi và tính toán. Với bài toán này nếu ta không đặt 4 ẩn rồi hệ 4 phương trình thì rất khó tìm được đáp số với thời gian cho phép. Để có thể xử lý được nhanh gọn các bài toán các em cần phải không ngừng luyện tập và trau dồi kinh nghiệm giải bài. |

Đáp án : C
Chất rắn sau phản ứng gồm 2 kim loại => chắc chắn là Cu và Fe
Hỗn hợp muối sau phản ứng gồm x mol MgCl2 và y mol FeCl2
Bảo toàn Cl : 2x + 2y = 2nCuCl2 + nHCl = 1,6 mol
Bảo toàn khối lượng : m + mCuCl2 + mHCl = m + mmuối + mH2 ( nH2 = ½ nHCl)
=> mmuối = 95x + 127y = 82,4g
=> x = 0,6 ; y = 0,2
=> mMg = 14,4g

Gọi: nMg = 2x (mol) ⇒ nMgO = x (mol)
⇒ 2x.24 + x.40 = 8,8 ⇒ x = 0,1 (mol)
⇒ nMg = 0,1.2 = 0,2 (mol)
PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
Theo PT: \(n_{H_2}=n_{Mg}=0,2\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,2.22,4=4,48\left(l\right)\)

$n_{Mg}+n_{Fe}=n_X=0,3$
Mà $n_{Mg}:n_{Fe}=2:1$
$\to n_{Mg}=2n_{Fe}$
$\to 2n_{Fe}+n_{Fe}=0,3$
$\to n_{Fe}=0,1(mol)$
$\to n_{Mg}=0,2(mol)$
$\to m_{hỗn\,hợp}=0,2.24+0,1.56=10,4(g)$

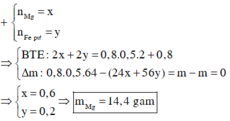
Chọn đáp án D