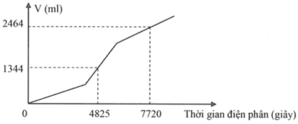
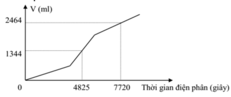
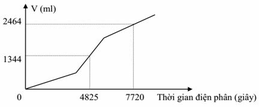
Tiến hành điện phân dung dịch chứa a mol CuSO4 và b mol NaCl bằng dòng điện một chiều có cường độ 2A (điện cực trơ, màng ngăn xốp, hiệu suất điện phân 100%, bỏ qua sự hòa tan của khí trong nước và sự bay hơi của nước). Gọi V là tổng thể tích khí (đktc) thoát ra ở cả hai điện cực. Quá trình điện phân được mô tả theo đồ thị sau:
Tỉ lệ a : b là:
A. 2 : 5
B. 1 : 3
C. 3 : 8
D. 1 : 2




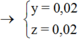

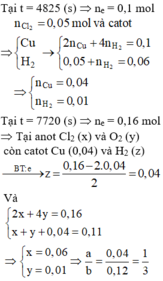

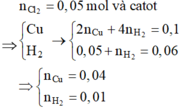
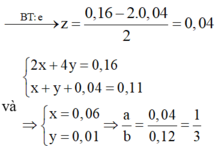

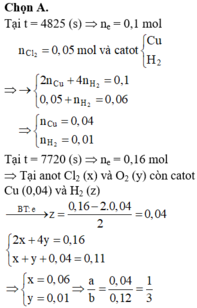

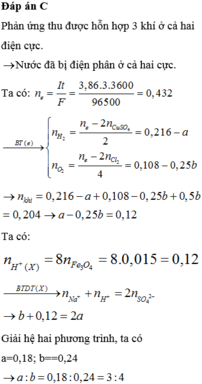

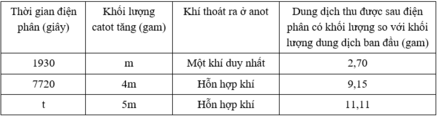

Đáp án B
Nhìn vào đồ thị, ta thấy quá trình điện phân gồm 3 giai đoạn.
• Giai đoạn 1:
Catot : Cu2+ + 2e → Cu Anot : 2Cl– → 1Cl2 + 2e
→ 2 mol e ứng với 1 mol khí sinh ra ở cả hai điện cực.
• Giai đoạn 2: Có hai trường hợp xảy ra.
+ Trường hợp 1: Cl– bị điện phân hết trước Cu2+.
Catot : Cu2+ + 2e → Cu Anot : H2O → 2H+ + 0,5O2 + 2e
→ 2 mol e ứng với 0,5 mol khí sinh ra ở cả hai điện cực.
+ Trường hợp 2: Cu2+ bị điện phân hết trước Cl– .
Catot: 2H2O → 2OH– + 1H2 + 2e Anot : 2Cl– → 1Cl2 + 2e
→ 2 mol e ứng với 2 mol khí sinh ra ở cả hai điện cực.
Nhìn vào đường gấp khúc của đồ thị, ta thấy đoạn hai dốc hơn đoạn một, do đó trường hợp xảy ra là trường hợp 2.
Số mol Cl2 thu được trong giai đoạn 1 là a. Gọi x là số mol Cl2 thu được từ khi Cu2+ bị điện phân hết cho đến thời điểm t1 = 4825s
Ta có hệ:
• Giai đoạn 3: H2O → H2 + 0,5O2
Gọi y là số mol Cl2 thu được trong giai đoạn 2, z là số mol H2O bị điện phân cho đến thời điểm
t2 = 7720 s.
Ta có hệ :
Bình luận : Câu hỏi yêu cầu học sinh phải hiểu rõ về quá trình điện phân. Các giai đoạn điện phân trên cũng chính là tổng quát hóa cho các dạng bài tập về điện phân dung dịch chứa Cu2+ và Cl–