Điện phân (với điện cực trơ, màng ngăn) dung dịch X chứa x mol CuSO4 và y mol NaCl (2x<y) bằng dòng điện một chiều có cường độ 2,68A, sau thời gian t giờ thu được dung dịch Y có khối lượng giảm so với dung dịch đầu là 18,95 gam. Thêm tiếp lượng dư Al vào dung dịch Y, thấy thoát ra 3,36 lít khí H2 (ở đktc) và dung dịch sau phản ứng chứa 2 chất tan có số mol bằng nhau. Giá trị của t là
A. 4 giờ.
B. 3 giờ.
C. 6 giờ.
D. 5 giờ.

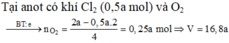

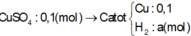
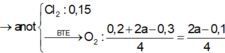
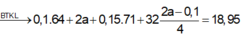

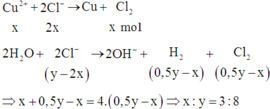


Đáp án D
Do 2x<y nên ta có các phương trình điện phân như sau:
CuSO4 + 2NaCl → Cu + Cl2 + Na2SO4
2H2O + 2NaCl → 2NaOH + Cl2 + H2 (nNaOH = nH2/1,5 = 0,15/1,5 = 0,1 mol)
2H2O → 2H2 + O2
Dung dịch Y: NaOH và Na2SO4
Sau khi cho Al dư vào thu được nNaAlO2 = nNa2SO4 = nH2/1,5 = 0,1 mol
(1) CuSO4 + 2NaCl → Cu + Cl2 + Na2SO4
0,1 0,2 0,1 0,1 ←0,1
(2) 2H2O + 2NaCl → 2NaOH + Cl2 + H2 (nNaOH = nH2/1,5 = 0,15/1,5 = 0,1 mol)
0,1 → 0,05 0,05
(3) 2H2O → 2H2 + O2
x
m dung dịch giảm = mCu + mCl2 + mH2 + mO2 => 18,95 = 0,1.64 + 0,15.71 + 0,05.2 + 18x => x = 0,1
n e = 2nCu + 2nH2(2) + 2nH2(3) = 0,1.2 + 0,05.2 + 0,1.2 = 0,5 mol
=> t = 0,5.96500/2,68 = 18003 giây = 5 giờ