Điện phân dung dịch gồm 0,1 mol AgNO3; 0,2 mol Cu(NO3)2; 0,1 mol Fe(NO3)3 với điện cực trơ, cường độ dòng điện 40A trong thời gian 965 giây thì khối lượng kim loại được giải phóng ở
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
∑ne trao đổi = 0,15 mol.
Vì 2nCu2+ > 0,15 ⇒ Cu2+ còn dư.
Vì nCl– < 0,15 ⇒ Ở Anot nước đã điện phân: 2H2O → O2 + 4H+ + 4e.
⇒ Trong dung dịch sau điện phân chứa: Cu(NO3)2 dư , KNO3 và HNO3 ⇒ Chọn B.

Các ion tham gia điện phân ở catot theo thứ tự tính oxi hóa từ mạnh đến yếu (Fe3+ > Cu2+ > H+ > Fe2+).
Khi ở catot bắt đầu thoát khí (tức H+ chỉ mới bắt đầu điện phân)
=> Fe3+ chỉ bị khử thành Fe2+ và Cu2+ bị khử hoàn toàn) => n(e trao đổi)=0,1.2+0,2.1=0,4
=> n(Cl2 ) = 0,2 => V = 4,48 (lít) => Đáp án B

Đáp án A
- Khí bắt đầu thoát ra ở catot là khi Fe3+, Cu2+ bị điện phân hết, H+ vừa bị điện phân
Phương trình điện phân:
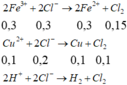
- Thêm dung dịch AgNO3 vừa đủ vào
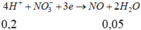
=> m Y =200+250-156,65-30.0,05-71.0,25=274,1 g
- Dung dịch Y Chứa 2 muối là: Fe(NO3)3 ; Cu(NO3)2
Muối có phân tử khối lớn hơn là Fe(NO3)3
C % Fe ( NO 3 ) 3 = 242 . 0 , 3 274 , 1 . 100 % = 26 , 49 % gần với giá trị 27 phút
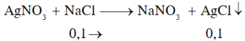







Chọn C. Các quá trình có thể xảy ra
Tại catot( theo thứ tự ưu tiên phản ứng trước):
(1) Ag+ + 1e → Ag
(2) Fe3+ + 1e → Fe2+
(3) Cu2+ +2e → Cu
(4) Fe2+ + 2e → Fe
Tại anot : (5) 2H2O → 4H+ + O2 + 4e
ne = 0,4 mol → không xảy ra (4). (1) và (2) xảy ra hoàn toàn, (3) xảy ra nhưng Cu2+ vẫn còn.
→ mKL = 108.mAg + 64nCu = 108.0,1 + 64.0,1= 17,2 g