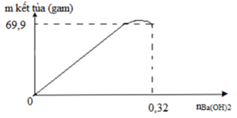
Nhỏ từ từ dung dịch Ba(OH)2 đến dư vào dung dịch chứa a mol Na2SO4 và b mol Al2(SO4)3. Lượng kết tủa tạo ra được biểu diễn bằng đồ thị bên. Giá trị của a là
A. 0,03.
B. 0,06.
C. 0,08.
D. 0,30.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B.
Ta có sơ đồ quá trình :
{Na2SO4:a; Al2(SO4)3:}+Ba(OH)2 0,32(mol) → BaSO4↓0,3(mol) + {Ba(AlO2)2: 0,02; NaAlO2: 2a}
Bảo toàn gốc SO42– ta có: a + 3b = 0,3 1.
Bảo toàn Al ta có: 0,02×2 + 2a = 2b ⇔⇔ 2a – 2b = –0,04 2
Giải hệ 1 và 2 ta có a = nNa2SO4 = 0,06 mol

Đáp án B
Ta có sơ đồ phản ứng sau:
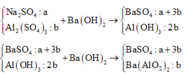
+ Từ sơ đồ trên ta có hpt:
PT theo số mol của BaSO4:
a + 3b = 69,9÷233 = 0,3 (1)
PT bảo toàn Bari:
a + 3b + b = a + 4b = 0,32 (2)
+ Giải hệ (1) và (2) ta có
a = nNa2SO4 = 0,24 mol

Đáp án B
Ta có sơ đồ phản ứng sau:
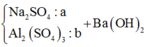
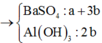
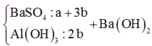
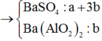
+ Từ sơ đồ trên ta có hệ phương trình:
PT theo số mol của BaSO4: a + 3b = 69,9÷233 = 0,3 (1)
PT bảo toàn Bari: a + 3b + b = a + 4b = 0,32 (2)
+ Giải hệ (1) và (2) ta có a = nNa2SO4 = 0,24 mol

Định hướng tư duy giải
Từ đồ thị có ngay Al2(SO4)3: a = 0,005
Điền số → B a 2 + : 0 , 045 S O 4 2 - : 0 , 015 N O 3 - : 3 b → b = 0 , 02 → a + b = 0 , 025
Giải thích:
Tại nBa(OH)2=0,32 mol thì Al(OH)3 vừa bị hòa tan hết.
=> 4nAl3+=nOH-=>4.2b=0,32=>b=0,04 mol.
Mặt khác nBaSO4 max=a+3b=69,9/233=0,3 mol
=>a=0,06 mol.
Đáp án B