Hòa tan hoàn toàn m gam hỗn hợp gồm Na2O và Al2O3 vào nước thu được dung dịch X trong suốt. Thêm từ từ dung dịch HCl 1M vào X, khi hết 150ml thì bắt đầu xuất hiện kết tủa, khi hết 350 ml hoặc 750 ml thì đều thu được a gam kết tủa. giá trị của m là
A. 27,70.
B. 30,80.
C. 33,30.
D. 29,25.

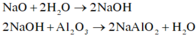
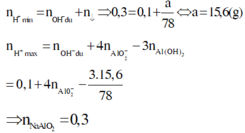
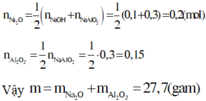
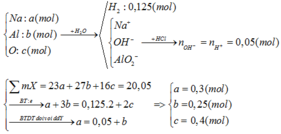
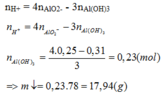
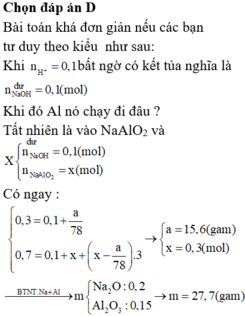
Giải thích:
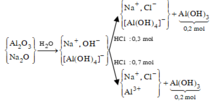
Na2O + H2O → 2NaOH (1)
Al2O3 + 2NaOH → 2NaAlO2 + H2O (2)
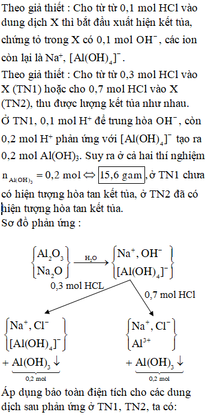
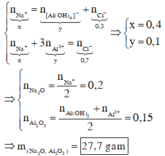
Vậy dung dịch X gồm: AlO2: b (mol) ; OH- , Na+
Khi hết 150ml dd HCl thì bắt đầu xuấ hiện kết tủa => nOH - dư = nHCl = 0,15 (mol)
Khi hết 350 ml hoặc 750 ml đều thu được a (gam) kết tủa
NaAlO2 + HCl + H2O → Al(OH)3↓ + NaCl (3)
2HCl + Al(OH)3 → AlCl3 + H2O (4)
TH1: Hết 350 ml HCl thu được a (g) kết tủa => phản ứng chỉ xảy ra (3)
=> nH+ = 0,35 = 0,15 + a/78 (*)
TH2: Hết 750 ml HCl thu được a (g) kết tủa => phản ứng chỉ xảy ra (3), (4)
=> nH+ = 0,75 = 0,15 + 4b - 3a/78 (**)
Từ (*) và (**) => a = 15,6 và b = 0,3 (mol)
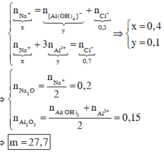
Bảo toàn điện tích đối với dd X : nNa+ = nAlO2- + nOH- = 0,3 + 0,15 = 0,45 (mol)
=> nNa2O = 0,225 (mol)
nAl2O3 = b/2 = 0,15 (mol)
=> m = 0,225.62 + 0,15. 102 = 29,25 (g)
Đáp án D