Cho nhôm tan hoàn toàn trong dung dịch loãng, nóng thu được khí N 2 O . Sau khi đã cân bằng, tỉ lệ giữa số nguyên tử Al bị oxi hoá và số phân tử H N O 3 bị khử (các số nguyên, tối giản) là
A. 8 và 30
B. 8 và 3
C. 8 và 15
D. 8 và 6
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

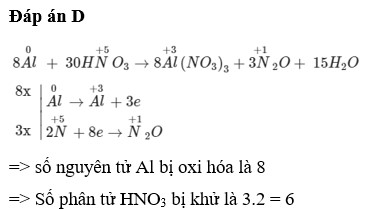

Đáp án D
Số phân tử bị khử chính bằng số phân tử N2O
8Al + 30HNO3 (loãng) → 8Al(NO3)3 + 3N2O + 15H2O

Đáp án : A
Số phân tử bị khử chính bằng số phân tử N2O
8Al + 30HNO3 à 8Al(NO3)3 + 3N2O + 15H2O

\(a.Zn+2HCl\rightarrow ZnCl_2+H_2\\ Tỉlệ:1nguyêntửZn:2phântửHCl:1phântửZnCl_2:1phântửH_2\\ b.CTkhốilượng:m_{Zn}+m_{HCl}=m_{ZnCl_2}+m_{H_2}\\ \Rightarrow m_{H_2}=m_{Zn}+m_{HCl}-m_{ZnCl_2}=6,5+27,4-32,2=1,7\left(g\right)\)

Đáp án A.
Ta có các quá trình :
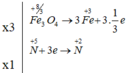
Số phân tử HNO3 đóng vai trò làm chất oxi hóa là 1
![]()
Fe3O4 là chất bị oxi hóa, HNO3 vừa là môi trường vừa là chất bị khử.

a, PTHH: Zn + 2HCl \(\rightarrow\) ZnCl2 + H2
Số nguyên tử Zn + số phân tử HCl : Số phân tử ZnCl2 : số phân tử H2 = 1:2:1:1
b, \(m_{H_2}=\left(\dfrac{17,92}{22,4}\right).2=1,6g\)
Theo ĐLBTKL, ta có:
\(m_{Zn}+m_{HCl}=m_{ZnCl_2}+m_{H_2}\)
\(\Rightarrow m_{ZnCl_2}=52+58,4-1,6=108,8g\)