Một bình kín chứa 1 moi khí nitơ ở áp suất 10 5 N / m 2 ở 27 ° C. Thể tích của bình xấp xỉ bằng bao nhiêu?
A. 2,5ℓ
B. 2,8 ℓ
C. 25 ℓ
D. 27,7 ℓ
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D.
Ta có: p 1 T 1 = p 2 T 2 ⇒ T 2 = p 2 p 1 . T 1 = 1500 K = 1227 0 C

Chọn đáp án B
? Lời giải:
+ Do V, T không đổi nên ta có:
v 3 = p 3 p 2 . v 1 = 0 , 8 mol
khí thoát ra 0,2 mol.

Gọi n là số mol khí cacbonic chứa trong bình: n = m/ μ , trong đó M là khối lượng khí cacbonic có trong bình, μ là khối lượng mol của khí cacbonic.
Ta có n = 100 mol
Nếu gọi V 0 là thể tích của lượng khí cacbonic ở điều kiện chuẩn ( p 0 = 1,013. 10 5 Pa; T 0 = 273 K) thì V 0 = n v 0
Áp dụng phương trình trạng thái của khí lí tưởng cho lượng khí cacbonic:
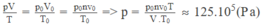

Xét lượng khí trong bình.
Trạng thái đầu: V 1 = 8 lít; T 1 = 100 + 273 = 373 K ; p 1 = 10 5 N/ m 2
Trạng thái cuối: V 2 = 8 lít; T 2 = 20 + 273 = 293 K; p 2 = ?
Vì thể tích không đổi nên:
p 1 / T 1 = p 2 / T 2 ⇒ p 2 = p 1 T 2 / T 1 = 7,86. 10 4 N/ m 2
Chọn đáp án C
? Lời giải: