Điện phân dung dịch NaOH với cường độ dòng điện là 10A trong thời gian 268h. Sau khi điện phân còn lại 100 gam dung dịch NaOH có nồng độ 24%. Nồng độ của dung dịch NaOH trước điện phân là
A. 4,2%
B. 2,4%
C. 1,4%
D. 4,8%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Đáp án B
Điện phân NaOH thì bản chất là sự điện phân nước
nH2 = It/(NF) = 10.268/(2.26,8) = 50 mol
2H2O → 2H2 + O2
50 ← 50 mol
=> mH2O = 50.18 = 900 gam
=> m dung dịch ban đầu = 100 + 900 = 1000 gam
m chất tan = mNaOH = 100.24/100 = 24 gam
=> C% NaOH bđ = 24.100/1000 = 2,4%

Đáp án B
Điện phân NaOH thì bản chất là sự điện phân nước
nH2 = It/(NF) = 10.(268.3600)/(2.96500) = 50 mol
2H2O → 2H2 + O2
50 ← 50 mol
=> mH2O = 50.18 = 900 gam
=> m dung dịch ban đầu = 100 + 900 = 1000 gam
m chất tan = mNaOH = 100.24/100 = 24 gam
=> C% NaOH bđ = 24.100/1000 = 2,4%

Đáp án B
Điện phân NaOH thì bản chất là sự điện phân nước
nH2 = It/(NF) = 10.268/(2.26,8) = 50 mol
2H2O → 2H2 + O2
50 ← 50 mol
=> mH2O = 50.18 = 900 gam
=> m dung dịch ban đầu = 100 + 900 = 1000 gam
m chất tan = mNaOH = 100.24/100 = 24 gam
=> C% NaOH bđ = 24.100/1000 = 2,4%

Đáp án B
Quá trình điện phân dung dịch NaOH chỉ xảy ra quá trình điện phân H2O làm tăng nồng độ của NaOH:
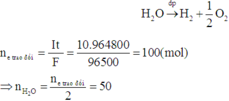
Dung dịch sau phản ứng có:
![]()
Do đó, trước điện phân, dung dịch có:
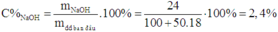

Đáp án : C
Chỉ xảy ra điện phân nước : ne = It/F = 1 mol
=> nH2 = nH2O đp = ½ ne = 0,5 mol
=> mdd đầu = mdd sau + mH2O đp = 100 + 0,5.18 = 109g
, mNaOH = 6g (không đổi)
=> C%dd đầu = 5,5%

Chọn A
ne = It/nF = 0,72 mol
2H2O + 2e -> H2 + 2OH-
2H2O -> 4H+ + O2 + 4e
=> 2H2O -> 2H2 + O2
=> nH2O đp = 0,36 mol
=> mdd dầu = mX + mH2O đp = 106,48g
,mNaOH = 24g => a = 22,54%