Cho hỗn hợp X gồm 0,04 mol Al và 0,06 mol Mg tan hoàn toàn trong H 2 SO 4 đặc nóng thu được 0,12 mol sản phẩm Z duy nhất do sự khử của S + 6 . Z là
A. H 2 S .
B. S.
C. SO 2 .
D. SO 3 .
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Hỗn hợp Z gồm CO và CO2 có M = 36 dùng đường chéo ⇒ CO = CO2 = 0,03 mol
nO phản ứng = CO = 0,03 mol
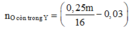
Khối lượng kim loại trong Y: 0,75m.
n N O 3 - tạo muối = 0,04.3 = 0,12 mol
![]()
⇒ m = 9,477
⇒Chọn C

Theo giả thiết: mO = 0.25a (g) => mKL = 0.75a (g);
=> nO = 0.25a/16 mol. nZ = nCO = 1.344/22.4 = 0.06 mol.
M (Z gồm CO & CO2)
Mz = 18*2 = 36 => nCO = nCO2 = 0.03 mol
=> nO pư( nguyên tử) = 0.03 mol => nO còn lại = 0.25a/16 -0.03 mol
Từ khối lượng muối = 3.08a => mNO3(-) = 3.08a - 0.75a = 2.33a (g).
Từ nNO = 0.04 => nNO3( trong muối) = 0.04*3 = 0.12 mol( ĐCGĐ)
Lượng NO3 tạo từ oxi: nNO3/oxit = 2.33a/62 - 0.12 mol
Từ đó suy ra: nNO3/oxit = 2* nO(còn lại) <=>2* (2.33a /62 - 0.12) = 0.25a/16 - 0.03 => a = 9.4777
=> Đáp án C

Ta có nMg= 0,06 mol; nAl= 1/15 mol
QT cho e :
Mg → Mg2++ 2e
Al→ Al3++ 3e
Có ne cho=2.nMg+ 3.nAl= 0,32 mol
QT nhận e
-Nếu khí X có 1 nguyên tử N: Gọi số oxi hóa của N trong X là a
N+5 + (5-a) e→ N+a
(5-a).0,04 0,04
Theo ĐL bảo toàn electron có: 0,32= 0,04. (5-a)→ a= -3→ Loại
-Nếu khí có 2 nguyên tử N:
2N+5 + 2(5-a) e→ N2+a
(5-a).0,08 0,04
Theo ĐL bảo toàn electron có: 0,32= 0,08. (5-a) → a= +1
→ Khí X là N2O
Đáp án C

- Hòa tan trong dd HNO3dư
* Quá trình e cho:
Fe - 3e -> \(Fe^{+3}\)
0,04 0,12
Mg - 2e -> Mg\(^{+2}\)
0,06 0,12
tổng e cho : 0,24 = e nhận
* Quá trình e nhận :
N\(^{+5}\) + (5-x)e -> N\(^{+x}\)
............0,24........0,24/5-x
=> nN (trong X ) = 0,24/5-x = 0,03 => x = -3
Vì N\(^{-3}\) => X là NH4NO3
Làm tương tự với phần dưới tìm đc Y là H2S
Đáp án đúng : C