Đốt cháy hoàn toàn một hiđrocacbon thu được số mol H 2 O gấp 2 lần số mol C O 2 . Công thức phân tử của hiđrocacbon là
A. C 2 H 6
B. C H 4
C. C 2 H 2
D. C 3 H 8
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi công thức của ba hiđrocacbon đó là : C x H y , C a H b , C n H m
Khi đốt ta có :
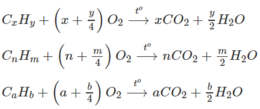
Vì số mol CO 2 tạo ra bằng 2 lần số mol hiđrocacbon đem đốt. Vậy theo phương trình hoá học của phản ứng cháy
→ X = a = n = 2.
Mặt khác : A không làm mất màu nước brom → không có liên kết đôi hoặc ba. Vậy A là CH 3 - CH 3
1 mol B chỉ tác dụng tối đa với 1 mol brom → có 1 liên kết đôi.
Vậy B là CH 2 = CH 2
1 mol C tác dụng tối đa với 2 mol brom → có liên kết ba.
Vậy C là CH ≡CH.

Bảo toàn O : $2n_{O_2} = 2n_{CO_2} + n_{H_2O} \Rightarrow n_{H_2O} = 0,6.2 - 0,4.2 = 0,4(mol)$
Số nguyên tử C = $n_{CO_2} : n_A = 4$
Số nguyên tử H = $2n_{H_2O} : n_A = 8$
Vậy CTPT là $C_4H_8$
CTCT :
$CH_2=CH-CH_2-CH_3$
$CH_3-CH=CH-CH_3$

- Đáp án C
- Khi đốt cháy X thu được CO2 và H2O có số mol theo tỉ lệ 2 : 1
⇒ X có số C bằng số H
Mà X là chất lỏng ở điều kiện thường nên X chỉ có thể là C6H6

\(n_A=n_{H_2}=\dfrac{0.336}{22.4}=0.015\left(mol\right)\)
\(\)\(n_{CO_2}=\dfrac{2.016}{22.4}=0.09\left(mol\right)\)
\(n_{H_2O}=\dfrac{0.81}{18}=0.045\left(mol\right)\)
\(\)\(\text{Số nguyên tử C : }\dfrac{0.09}{0.015}=6\)
\(\text{Số nguyên tử H: }\dfrac{0.045\cdot2}{0.015}=6\)
\(CT:C_6H_6\)

Căn cứ vào 4 đáp án ta có Y là ankan.
Do đó gọi công thức trung bình của hỗn hợp M là C n H 2 n + 2 O x
Phương trình đốt cháy

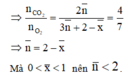
Mà hai chất trong M có cùng số nguyên tử C nên Y là CH4.
Đáp án C
Chọn đáp án B
n H 2 O > n C O 2 → ankan → C H 4