Điều chế khí oxi bằng cách nhiệt phân KMn O 4 . Kết quả của thí nghiệm được ghi lại như sau :
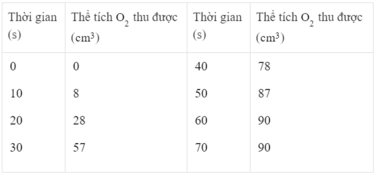
Vẽ đồ thị biểu diễn thể tích khí oxi thu được theo thời gian (trục tung là thể tích khí oxi, trục hoành là thời gian).
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Thể tích khí oxi thu được ở các thời điểm :
25 giây : Khoảng 40 cm 3
45 giây : Khoảng 83 cm 3

Phản ứng kết thúc ở thời điểm 60 giây và thể tích khí oxi thu được là 90 cm 3

Thể tích khí hiđro :
Sau các thí nghiệm, kẽm còn dư. Như vậy, thể tích khí hiđro được sinh ra phụ thuộc vào lượng H 2 SO 4 tham gia phản ứng
n H 2 = n H 2 SO 4 = 2.50/1000 = 0,1 mol
Thể tích khí hiđro ở điều kiện phòng là :
V H 2 = 0,1 x 24 = 2,4l = 2400 cm 3
Ta ghi số 2400 cm 3 trên trục y, nơi giao điểm giữa trục y và đường ngang của 3 đường cong kéo dài (nét chấm trên đồ thị).

Nếu thay dung dịch HCl có nồng độ cao hơn thì đường cong sẽ có độ dốc lớn hơn, phản ứng sẽ kết thúc nhanh hơn, nhưng thể tích khí H 2 S hu được là không đổi. Trên đồ thị, đường cong này được biểu diễn bằng đường đứt nét.

\(a.2KClO_3-^{t^o}\rightarrow2KCl+3O_2\\ n_{O_2}=\dfrac{3}{2}n_{KClO_3}=0,6\left(mol\right)\\ \Rightarrow V_{O_2}=0,6.22,4=13,44\left(l\right)\\ n_{KCl}=n_{KClO_3}=0,4\left(mol\right)\\ \Rightarrow m_{KCl}=0,4.74,5=29,8\left(g\right)\)

Chọn C
Hình vẽ mô tả điều chế khi O2 đúng cách là 1 và 3. Vì O2 nặng hơn không khí và không tan trong nước nên có thể thu O2 bằng cách đẩy nước hoặc đẩy không khí. Ống nghiệm chứa O2 hơi trúc xuống để oxi và hơi nước thoát ra dễ dàng hơn (KClO3 trong PTN thường bị ẩm).

Chọn đáp án C.
Hình vẽ mô tả điều chế khi O 2 đúng cách là 1 và 3. Vì O 2 nặng hơn không khí và không tan trong nước nên có thể thu O 2 bằng cách đẩy nước hoặc đẩy không khí. Ống nghiệm chứa O 2 hơi trúc xuống để oxi và hơi nước thoát ra dễ dàng hơn ( K C l O 3 trong PTN thường bị ẩm).
Xem đồ thị sau :