Cho 6,48 gam một kim loại phản ứng hết với dung dịch HCl dư, thu được 8,064 lít H2 (đktc). Kim loại đó là:
A. Al
B. Zn
C. Fe.
D. Mg
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Giả sử kim loại đó là M có hóa trị n.
Phản ứng:
![]()
![]() mol.
mol.
![]()
ứng với
→ M = 27 là kim loại Al → chọn đáp án A.

Đáp án B.
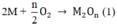
Chất rắn sau phản ứng hòa tan trong HCl thấy có khí thoát ra chứng ở có M dư
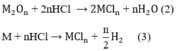
Số mol H2: 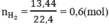
Theo phương trình (1)
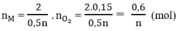
Theo phương trình (3)
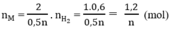
Tổng số mol M là 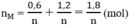
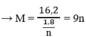
⇒ Giá trị thỏa mãn là n = 3, M = 27 M : Al

Đáp án : B
Vì phản ứng các axit đồng thời => số mol HCl và H2SO4 phản ứng theo tỷ lệ mol giống như nồng độ mol ban đầu của chúng
=> nHCl : nH2SO4 = 1,5 : 0,45 = 10 : 3 = 10x : 3x
=> 2nH2 = nHCl + 2nH2SO4 => 1,2 mol = 10x + 2.3x
=> x = 0,075 mol
=> Trong muối có : 0,225 mol SO42- và 0,75 mol Cl- ; ion kim loại
( phản ứng hết axit)
=> mmuối = 11,61 + 0,225.96 + 0,75.35,5 = 59,835g

2R+2xHCl---->2RClx+xH2
n H2=5,376/22,4=0,24(mol)
n R=2/x n H2=0,48/x(g)
M R=15,6: 0,48/x=32,5x(đề là 15,6 thì hợp lý hơn ấy ạ)
+x=2--->R=65(Zn)
Vậy R là kẽm

Đáp án : C
M + 2HCl -> MCl2 + H2
=> n M = n H 2 = 0,0125 mol
=> MM = 24g (Mg)

Đáp án : B
M + 2HCl -> MCl2 + H2
=> nM = nH2 = 0,05 mol
=> MM = 24g (Mg)
Chọn đáp án A