Hoà tan hoàn toàn 8,9 gam hỗn hợp gồm Mg và Zn bằng dung dịch H2SO4 loãng dư thấy thu được 4,48 lít H2 (đktc). Phần trăm số mol của Mg trong hỗn hợp là
A. 26,97%
B. 38,16%
C. 50,00%
D. 73,03%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
n H 2 = 0 , 2 ( m o l )
=> mhh= mFe + mAl
Bảo toàn electron:
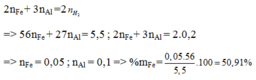

n H 2 = 1,344/22,4 = 0,06
n H 2 SO 4 = n H 2 = 0,060
n SO 4 2 - = n H 2 SO 4 = 0,06
m muối = m kim loại + m SO 4 2 - = 3,22 + 0,06 x 96 = 8,98g

Coi hỗn hợp Y gồm :
Kim loại : 14,3(gam)
O :(x mol)
\(2H^+ + O^{2-}\to H_2O\\ 2H^+ + 2e \to H_2\)
Ta có : \(n_{Cl^-} = n_{HCl} = n_{H^+} = 2n_O + 2n_{H_2} = 2x + 0,4(mol)\)
Mà :
\(m_{muối} = m_{kim\ loại} + m_{Cl^-} = 14,3 + (2x + 0,4).35,5 = 49,8(gam)\\ \Rightarrow x = 0,3\)
Vậy : \(a = m_{kim\ loại} + m_O = 14,3 + 0,3.16 = 19,1(gam)\)
Đáp án : C
Ta có : 24nMg + 65nZn = 8,9g
Và nH2 = nMg + nZn = 0,2 mol
=> nMg = nZn = 0,1 mol => %nMg = 50%