Ngâm một lá kim loại có khối lượng 50 gam trong dung dịch HCl. Sau khi thu được 336 ml khí H2 (đktc) thì khối lượng lá kim loại giảm 1,68% so với ban đầu. Kim loại đó là A.
A. Zn.
B. Fe.
C. Ni.
D. Al.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


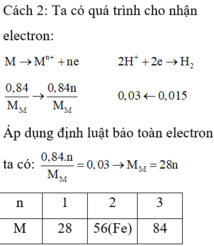

Đáp án B.
Khối lượng kim loại phản ứng là 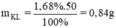
Số mol H2 là 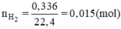
2M + 2n HCl → 2MCl2 + nH2
Số mol của M là:
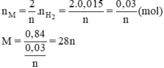
→ {n = 2, M = 56} → M: Fe
Đặt kim loại cần tìm là X, có hóa trị n
Khối lượng kim loại giảm 1,68% → mX phản ứng = 50.1,68% = 0,84 gam
PTHH: 2X+ 2nHCl → 2XCln + nH2
Ta có: nX = (2/n).nH2 ⇔ (0,84/X) = (0,015.2/n)
⇔ X = 28n
Vậy X là Fe
B nha

Đáp án C
mKL giảm = 50.1,68% = 0,84g = mKL phản ứng
nH2 = 0,336: 22,4 = 0,015 mol
Gọi kim loại cần tìm là M có hóa trị n
M + nHCl → MCln + 0,5nH2
=> nM = 2/n.nH2 = 0,03/n mol
=> MM = 0,84: (0,03/n) = 28n
Với n = 2 => MM = 56 g/mol (Fe)

Em kiểm tra đề nha
Kim loại không giảm khối lượng đâu em

Chọn Đáp án B
Gọi n là hóa trị của kim loại R cần tìm
Ta có : $n_{H_2} =\dfrac{336}{1000.22,4} = 0,015(mol) ; m_{R\ phản\ ứng} = 50.1,68\% = 0,84(gam)$
$2R + 2nHCl \to 2RCl_n + nH_2$
Theo PTHH :
$n_{H_2} = \dfrac{2}{n}n_{H_2} = \dfrac{0,03}{n}(mol)$
$\Rightarrow \dfrac{0,03}{n}.R = 0,84$
$\Rightarrow R = 28n$
Với n = 2 thì R = 56(Fe)$

a) Gọi kim loại cần tìm là M
\(m_{M\left(pư\right)}=\dfrac{50.1,68}{100}=0,84\left(g\right)\)
\(n_{H_2}=\dfrac{0,336}{22,4}=0,015\left(mol\right)\)
PTHH: 2M + 2xHCl --> 2MClx + xH2
\(\dfrac{0,03}{x}\) <--------------------0,015
=> \(M_M=\dfrac{0,84}{\dfrac{0,03}{x}}=28x\left(g/mol\right)\)
Xét x = 1 => L
Xét x = 2 => MM = 56(Fe)
b) Mình nghĩ đề thiếu dữ kiện :v